
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страницы 89-90 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
Часть I
1. Признаки кислот:
— ______ вещества;
— состоят из атомов ______ и ______;
— в растворе образуют простые ионы ______ и сложные или простые ионы ______ — Acd.
Общая формула кислот: HₙAcdⁿ⁻, где n — заряд кислотного остатка.
2. Классификация кислот.
3. Способ образования названий кислот.
1) Бескислородных.
HCl — ______, H₂S — ______
2) Кислородсодержащих.
HNO₂ — ______, HNO₃ — ______
Часть I
Вопрос 1
Признаки кислот:
- СЛОЖНЫЕ вещества
- Состоят из атомов ВОДОРОДА и КИСЛОТНОГО ОСТАТКА
- В растворе образуют простые ионы H⁺ и сложные или простые ионы КИСЛОТНОГО ОСТАТКА — Acd.
Вопрос 2
Классификация кислот:
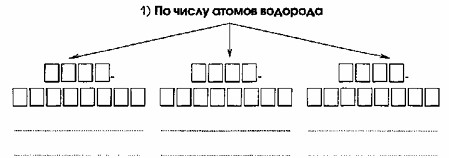
1. По числу атомов водорода:
- Одноосновные: HCl, HNO₃, HBr
- Двухосновные: H₂SO₄, H₂SO₃, H₂S
- Трёхосновные: H₃PO₄
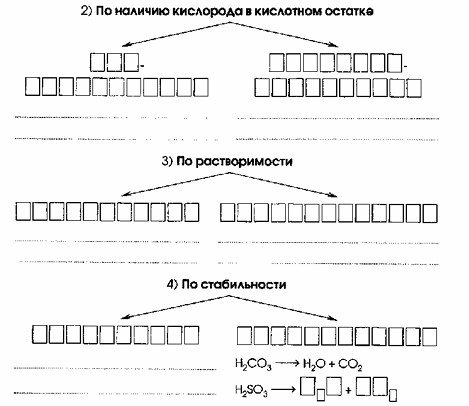
2. По наличию кислорода в кислотном остатке:
- Бескислородные: HCl, HBr, H₂S
- Кислородсодержащие: H₂SO₄, H₂SO₃, HNO₃
3. По растворимости:
- Растворимые: H₂SO₄, H₂SO₃, HNO₃
- Нерастворимые: H₂SiO₃
4. По стабильности:
- Стабильные: HCl, H₂SO₄, H₃PO₄
- Нестабильные:
H₂CO₃ → H₂O + CO₂↑
H₂SO₃ → H₂O + SO₂↑
Вопрос 3
Способ образования названий кислот.
1) Бескислородных:
HCl — ХЛОРОВОДОРОДНАЯ
H₂S — СЕРОВОДОРОДНАЯ
2) Кислородсодержащих:
HNO₂ — АЗОТИСТАЯ
HNO₃ — АЗОТНАЯ
Часть I
Вопрос 1
Признаки кислот:
- СЛОЖНЫЕ вещества
- Состоят из атомов ВОДОРОДА и КИСЛОТНОГО ОСТАТКА
- В растворе образуют простые ионы H⁺ и сложные или простые ионы КИСЛОТНОГО ОСТАТКА — Acd.
1. Сложные вещества
Почему «сложные»?
В химии вещества делятся на простые и сложные:
Простые состоят только из атомов одного элемента (например, O₂, H₂, Fe).
Сложные состоят из атомов разных элементов.
Кислоты всегда содержат как минимум два разных элемента: водород и кислотный остаток (например, HCl, H₂SO₄). Поэтому они относятся к сложным веществам.
2. Состоят из атомов водорода и кислотного остатка
Почему именно водорода и кислотного остатка?
В состав любой кислоты обязательно входят атомы водорода (H), а также так называемый «кислотный остаток» — это часть молекулы, которая остаётся после отщепления ионов водорода.
Например, в HCl кислотный остаток — это Cl (хлорид).
В H₂SO₄ — SO₄ (сульфат).
Таким образом:
В формуле кислоты всегда есть атом(ы) водорода и кислотный остаток.
3. В растворе образуют простые ионы H⁺ и сложные или простые ионы кислотного остатка — Acd
Что происходит в растворе?
Кислоты — это вещества, которые в водном растворе диссоциируют (распадаются) на ионы:
Обязательно выделяется ион водорода H⁺ (он же протон).
Вторая часть — это ион кислотного остатка (он может быть простым, как Cl⁻, или сложным, как SO₄²⁻).
Примеры:
HCl → H⁺ + Cl⁻
(H⁺ — простой ион, Cl⁻ — тоже простой)
H₂SO₄ → 2H⁺ + SO₄²⁻
(H⁺ — простой, SO₄²⁻ — сложный ион)
Поэтому:
В растворе кислоты всегда дают ионы H⁺ и ионы кислотного остатка.
Вопрос 2
Классификация кислот:
1. По числу атомов водорода
Эта классификация делит кислоты по количеству атомов водорода, способных замещаться на металл (или по количеству протонов H⁺, которые кислота может отдать в растворе).
Схема: На схеме видно три ветви, что соответствует трем категориям.
Ответ:
- Одноосновные: HCl, HNO₃, HBr
- Двухосновные: H₂SO₄, H₂SO₃, H₂S
- Трёхосновные: H₃PO₄
Объяснение:
Одноосновные кислоты (например, HCl, HNO₃) имеют один атом водорода, который может диссоциировать, то есть отдать один протон H⁺.
Заполнение блоков: В верхние блоки первой ветви вписываем «Одноосновные». В нижние блоки — примеры: «HCl», «HNO₃», «HBr».
Двухосновные кислоты (например, H₂SO₄, H₂S) имеют два атома водорода, способных к диссоциации.
Заполнение блоков: В верхние блоки второй ветви вписываем «Двухосновные». В нижние блоки — примеры: «H₂SO₄», «H₂SO₃», «H₂S».
Трёхосновные кислоты (например, H₃PO₄) имеют три атома водорода, способных к диссоциации.
Заполнение блоков: В верхние блоки третьей ветви вписываем «Трёхосновные». В нижние блоки — пример: «H₃PO₄».
2. По наличию кислорода в кислотном остатке
Эта классификация делит кислоты на две группы в зависимости от того, содержит ли их кислотный остаток атомы кислорода.
Схема: На схеме видно две ветви.
Ответ:
- Бескислородные: HCl, HBr, H₂S
- Кислородсодержащие: H₂SO₄, H₂SO₃, HNO₃
Объяснение:
Бескислородные кислоты (например, HCl, H₂S) не содержат атомов кислорода в своем составе. Их кислотный остаток состоит только из атомов неметалла (например, Cl⁻, S²⁻).
Заполнение блоков: В верхние блоки первой ветви вписываем «Бескислородные». В нижние блоки — примеры: «HCl», «HBr», «H₂S».
Кислородсодержащие кислоты (например, H₂SO₄, HNO₃) содержат атомы кислорода в своем кислотном остатке (например, SO₄²⁻, NO₃⁻).
Заполнение блоков: В верхние блоки второй ветви вписываем «Кислородсодержащие». В нижние блоки — примеры: «H₂SO₄», «H₂SO₃», «HNO₃».
3. По растворимости
Эта классификация делит кислоты на растворимые и нерастворимые в воде.
Схема: На схеме видно две ветви.
Ответ:
- Растворимые: H₂SO₄, H₂SO₃, HNO₃
- Нерастворимые: H₂SiO₃
Объяснение:
Большинство кислот хорошо растворимы в воде.
Заполнение блоков: В верхние блоки первой ветви вписываем «Растворимые». В нижние блоки — примеры: «H₂SO₄», «H₂SO₃», «HNO₃».
Нерастворимые кислоты встречаются реже. Наиболее известная нерастворимая кислота — кремниевая кислота (H₂SiO₃), которая является студенистым осадком.
Заполнение блоков: В верхние блоки второй ветви вписываем «Нерастворимые». В нижние блоки — пример: «H₂SiO₃».
4. По стабильности
Эта классификация делит кислоты на стабильные и нестабильные, то есть те, которые легко разлагаются.
Схема: На схеме видно две ветви, одна из которых уже содержит пример разложения.
Ответ:
- Стабильные: HCl, H₂SO₄, H₃PO₄
- Нестабильные:
H₂CO₃ → H₂O + CO₂↑
H₂SO₃ → H₂O + SO₂↑
Объяснение:
Стабильные кислоты (например, HCl, H₂SO₄) не разлагаются при обычных условиях (нагревании, хранении).
Заполнение блоков: В верхние блоки первой ветви вписываем «Стабильные». В нижние блоки — примеры: «HCl», «H₂SO₄», «H₃PO₄».
Нестабильные кислоты (например, угольная H₂CO₃ и сернистая H₂SO₃) легко разлагаются на воду и соответствующий оксид неметалла.
Заполнение блоков: В верхние блоки второй ветви вписываем «Нестабильные».
На схеме уже есть уравнение для H₂CO₃. Для H₂SO₃ необходимо заполнить пустые блоки продуктами разложения:
H₂SO₃ → H₂O + SO₂↑
Заполнение блоков: В пустые блоки после стрелки вписываем «H₂O» и «SO₂».
Вопрос 3
Решение основано на правилах образования названий кислот, представленных на схеме, и применении их к данным примерам.
1. Название бескислородных кислот
Правило на схеме: Для бескислородных кислот используется структура: «неметалл»-о-водородная кислота.
Это означает, что название кислоты образуется от названия неметалла, входящего в ее состав, с добавлением суффикса «-о-» и слова «водородная кислота».
Примеры:
HCl:
Неметалл в составе HCl — хлор.
Применяя правило, получаем: хлороводородная кислота.
H₂S:
Неметалл в составе H₂S — сера.
Применяя правило, получаем: сероводородная кислота.
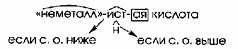
2. Название кислородсодержащих кислот
Правило на схеме: Для кислородсодержащих кислот название образуется от названия неметалла с добавлением суффиксов «-ист-» или «-н-» (подразумевается из «ая» после «неметалл» и ветки «если с. о. выше») в зависимости от степени окисления (с. о.) неметалла.
- «неметалл»-ист-ая кислота: используется, если степень окисления неметалла ниже (например, низшая или промежуточная).
- «неметалл»-н-ая кислота (подразумевается из «если с. о. выше»): используется, если степень окисления неметалла выше (обычно высшая).
Примеры:
HNO₂ (Азотистая кислота):
Определяем степень окисления азота (N) в HNO₂:
Водород (H) имеет с. о. +1.
Кислород (O) имеет с. о. -2.
Пусть с. о. азота = x.
Уравнение: (+1) + x + 2*(-2) = 0
1 + x — 4 = 0
x — 3 = 0
x = +3
Степень окисления азота в HNO₂ равна +3. Это более низкая степень окисления по сравнению с HNO₃ (+5).
Применяем правило для «если с. о. ниже»: азотистая кислота.
HNO₃ (Азотная кислота):
Определяем степень окисления азота (N) в HNO₃:
Водород (H) имеет с. о. +1.
Кислород (O) имеет с. о. -2.
Пусть с. о. азота = x.
Уравнение: (+1) + x + 3*(-2) = 0
1 + x — 6 = 0
x — 5 = 0
x = +5
Степень окисления азота в HNO₃ равна +5. Это высшая степень окисления азота в кислотах.
Применяем правило для «если с. о. выше»: азотная кислота.
Таким образом, названия кислот образуются систематически, исходя из наличия кислорода и степени окисления центрального неметалла.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.


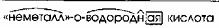



Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!