
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страницы 92-93 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
6. Кислоты изменяют окраску индикаторов. Дополните таблицу «Изменение окраски индикатора в кислой среде».
| ИНДИКАТОР | ОКРАСКА В НЕЙТРАЛЬНОЙ СРЕДЕ | ОКРАСКА В КИСЛОЙ СРЕДЕ |
|---|---|---|
| Красная | ||
| Оранжевая | ||
| Фенолфталеин |
Часть II
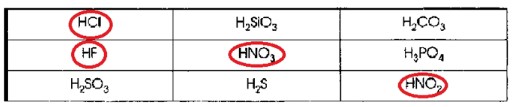
1. Поиграйте в «крестики-нолики». Покажите выигрышный путь, который составляют формулы одноосновных кислот.
| HCl | H2SiO3 | H2CO3 |
| HF | HNO3 | H3PO4 |
| H2SO3 | H2S | HNO2 |
Распределите все приведённые выше кислоты по группам. Запишите их названия.
2. Дайте характеристику фосфорной _________ кислоты по всем признакам классификации.
Текст из изображения:
3. Напишите формулы кислот и соответствующих им оксидов, образованных неметаллами в следующих степенях окисления:
1) S⁺⁶ →
2) S⁺² →
3) N⁺⁵ →
4. Определите заряды ионов, степени окисления элементов в кислотах.
| СОЕДИНЕНИЕ | ЗАРЯДЫ ИОНОВ | С. О. ЭЛЕМЕНТОВ |
|---|---|---|
| HNO₃ | ||
| H₂SO₄ | ||
| H₃PO₄ |
5. Установите соответствие между опасной ситуацией и необходимыми действиями по оказанию первой помощи во избежание химического ожога.
ПРИ ПОПАДАНИИ НА КОЖУ РАСТВОРА
А) кислоты
Б) щёлочи
НЕОБХОДИМО
1) смыть химические растворы большим количеством воды
2) промыть место ожога слабым раствором питьевой соды
3) промыть место ожога раствором борной кислоты или слабым раствором уксусной кислоты
Вопрос 6
Изменение окраски индикатора в кислой среде
| Индикатор | Окраска индикатора в нейтральной среде | Окраска индикатора в кислой среде |
|---|---|---|
| Лакмус | Фиолетовая | Красная |
| Метилоранж | Оранжевый | Красная |
| Фенолфталеин | Бесцветная | Бесцветная |
Часть II
Вопрос 1
Вопрос 2
Фосфорная кислота – H₃PO₄
1. Трехосновная
2. Кислородсодержащая
3. Стабильная
4. Растворимая
Вопрос 3
1. S⁺⁶: H₂SO₄ → SO₃
2. S⁺²: H₂S → SO
3. N⁺⁵: HNO₃ → N₂O₅
Вопрос 4
| Соединение | Заряды ионов | С.о. элементов |
|---|---|---|
| HNO₃ | H⁺NO₃⁻ | H⁺N⁺⁵O⁻²₃ |
| H₂SO₄ | H⁺₂SO₄⁻² | H⁺₂S⁺⁶O⁻²₄ |
| H₃PO₄ | H⁺₃PO₄⁻³ | H⁺₃P⁺⁵O⁻²₄ |
Вопрос 5
| А | Б |
|---|---|
| 1,2 | 1,3 |
Вопрос 6
Индикаторы — это особые химические вещества (чаще всего, слабые органические кислоты или основания), которые способны изменять свой цвет в зависимости от концентрации ионов водорода (H⁺) в растворе, то есть от его pH. Это происходит потому, что индикатор существует в двух формах (протонированной и депротонированной), каждая из которых имеет свой цвет. Сдвиг равновесия между этими формами под действием изменения pH приводит к изменению цвета.
Лакмус:
В нейтральной среде: Лакмус имеет фиолетовую или пурпурную окраску.
В кислой среде: При добавлении кислоты (увеличении концентрации H⁺) равновесие индикатора смещается, и он приобретает красную окраску.
Для полноты: В щелочной среде лакмус становится синим.
Метилоранж:
В нейтральной среде: Метилоранж имеет оранжевую окраску.
В кислой среде: При подкислении раствора метилоранж становится красным. Его переход происходит в диапазоне pH 3.1–4.4.
Для полноты: В щелочной среде метилоранж становится желтым.
Фенолфталеин:
В нейтральной среде: Фенолфталеин бесцветен.
В кислой среде: Он также остается бесцветным. Фенолфталеин используется для определения щелочной среды, так как он изменяет цвет только при pH выше 8.2.
Для полноты: В щелочной среде (pH > 8.2) фенолфталеин приобретает характерную малиновую (или ярко-розовую) окраску.
Итоговая таблица:
| Индикатор | Окраска индикатора в нейтральной среде | Окраска индикатора в кислой среде |
|---|---|---|
| Лакмус | Фиолетовая | Красная |
| Метилоранж | Оранжевый | Красная |
| Фенолфталеин | Бесцветная | Бесцветная |
Часть II
Вопрос 1
Найти выигрышный путь, состоящий из формул одноосновных кислот.
Одноосновные кислоты (или монопротонные) — это кислоты, молекулы которых содержат только один атом водорода, способный отщепляться в виде иона H⁺ при диссоциации в водном растворе.
Количество таких атомов водорода называется основностью кислоты.
Давайте проанализируем каждую кислоту из предложенного поля:
- HCl (хлороводородная/соляная кислота): Содержит 1 атом H. Одноосновная.
- H₂SiO₃ (кремниевая кислота): Содержит 2 атома H. Двухосновная.
- H₂CO₃ (угольная кислота): Содержит 2 атома H. Двухосновная.
- HF (фтороводородная/плавиковая кислота): Содержит 1 атом H. Одноосновная.
- HNO₃ (азотная кислота): Содержит 1 атом H. Одноосновная.
- H₃PO₄ (фосфорная кислота): Содержит 3 атома H. Трехосновная.
- H₂SO₃ (сернистая кислота): Содержит 2 атома H. Двухосновная.
- H₂S (сероводородная кислота): Содержит 2 атома H. Двухосновная.
- HNO₂ (азотистая кислота): Содержит 1 атом H. Одноосновная.
Выигрышный путь в «крестиках-ноликах» — это три элемента подряд по горизонтали, вертикали или диагонали.
Если мы выделим одноосновные кислоты, то увидим, что HCl, HNO₃, HNO₂ образуют диагональ (сверху слева вниз направо).
Классификация кислот
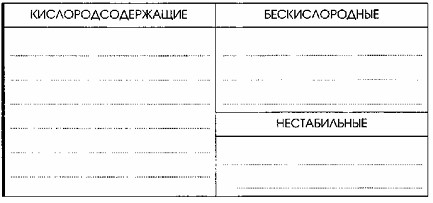
Распределить все приведенные выше кислоты по группам: кислородсодержащие/бескислородные и стабильные/нестабильные, а также записать их названия.
Кислоты классифицируются по нескольким признакам:
По наличию кислорода:
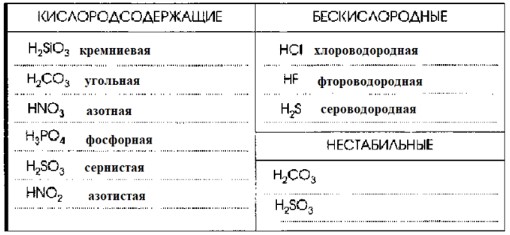
Кислородсодержащие кислоты: В их составе, помимо водорода и кислотообразующего элемента (неметалла), есть атомы кислорода.
- H₂SiO₃ (кремниевая кислота)
- H₂CO₃ (угольная кислота)
- HNO₃ (азотная кислота)
- H₃PO₄ (фосфорная кислота)
- H₂SO₃ (сернистая кислота)
- HNO₂ (азотистая кислота)
Бескислородные кислоты: В их составе нет атомов кислорода. Обычно это растворы газообразных галогеноводородов или халькогеноводородов в воде.
- HCl (хлороводородная/соляная кислота)
- HF (фтороводородная/плавиковая кислота)
- H₂S (сероводородная кислота)
По стабильности:
Стабильные кислоты: Это кислоты, которые не разлагаются при обычных условиях (комнатной температуре, в водном растворе). Большинство кислот стабильны.
HCl, HF, HNO₃, H₃PO₄, H₂SO₄ (если бы она была в списке), H₂S
Нестабильные кислоты: Это кислоты, которые легко разлагаются на воду и соответствующий кислотный оксид (ангидрид) при нагревании или даже при комнатной температуре.
- H₂CO₃ (угольная кислота): Разлагается на углекислый газ и воду: H₂CO₃ → H₂O + CO₂↑
- H₂SO₃ (сернистая кислота): Разлагается на сернистый газ и воду: H₂SO₃ → H₂O + SO₂↑
Итоговая таблица классификации:
Вопрос 2
Задача: Дать характеристику фосфорной кислоты по всем признакам классификации.
Фосфорная (ортофосфорная) кислота, H₃PO₄, является одной из важнейших неорганических кислот.
По основности (количество замещаемых атомов H):
H₃PO₄ содержит три атома водорода, которые способны отщепляться в виде ионов H⁺. Поэтому она является трехосновной кислотой. Ее диссоциация происходит ступенчато:
1. H₃PO₄ ⇌ H⁺ + H₂PO₄⁻
2. H₂PO₄⁻ ⇌ H⁺ + HPO₄²⁻
3. HPO₄²⁻ ⇌ H⁺ + PO₄³⁻
По наличию кислорода:
Молекула H₃PO₄ содержит атомы кислорода (4 атома). Следовательно, это кислородсодержащая кислота.
По стабильности:
Фосфорная кислота является стабильной кислотой. Она не разлагается при обычных условиях и не является летучей. При нагревании она может терять воду, образуя другие фосфорные кислоты (например, пирофосфорную H₄P₂O₇ или метафосфорную HPO₃), но это не является нестабильностью в том смысле, как для угольной или сернистой кислот.
По растворимости в воде:
Фосфорная кислота хорошо растворима в воде в любых соотношениях. Ее концентрированные растворы представляют собой вязкую жидкость.
Итоговая характеристика:
1. Трехосновная
2. Кислородсодержащая
3. Стабильная
4. Растворимая
Вопрос 3
Задача: Написать формулы кислот и соответствующих им оксидов, образованных неметаллами в указанных степенях окисления.
Для большинства неметаллов, находящихся в высших (или характерных) положительных степенях окисления, существуют соответствующие кислотные оксиды (ангидриды) и кислоты. Кислотный оксид при взаимодействии с водой образует соответствующую кислоту.
S⁺⁶ (Сера в степени окисления +6):
Кислота: Серная кислота, H₂SO₄. В ней степень окисления серы равна +6 (2*(+1) + S + 4*(-2) = 0 => S = +6).
Соответствующий оксид: Серный ангидрид (оксид серы(VI)), SO₃. Это оксид, в котором сера также имеет степень окисления +6.
Реакция образования кислоты из оксида: SO₃ + H₂O → H₂SO₄
S⁺² (Сера в степени окисления +2):
Кислота: H₂S (сероводородная кислота). Здесь сера имеет степень окисления -2.
Соответствующий оксид (если бы сера была +2): SO (монооксид серы). Здесь сера имеет степень окисления +2.
Важно отметить: SO не является кислотным оксидом H₂S. H₂S не образует кислотного оксида, так как это бескислородная кислота. SO — это нейтральный оксид, который к тому же крайне нестабилен.
N⁺⁵ (Азот в степени окисления +5):
Кислота: Азотная кислота, HNO₃. В ней степень окисления азота равна +5 (1*(+1) + N + 3*(-2) = 0 => N = +5).
Соответствующий оксид: Оксид азота(V) (пентаоксид диазота), N₂O₅. Это кислотный оксид, в котором азот также имеет степень окисления +5.
Реакция образования кислоты из оксида: N₂O₅ + H₂O → 2HNO₃
Итоговый ответ:
1. S⁺⁶: H₂SO₄ → SO₃
2. S⁺²: H₂S → SO
3. N⁺⁵: HNO₃ → N₂O₅
Вопрос 4
Задача: Определить заряды ионов и степени окисления элементов в кислотах HNO₃, H₂SO₄, H₃PO₄.
Заряд иона: Это электрический заряд, который приобретает атом или группа атомов при потере или приобретении электронов. В случае кислот, при диссоциации в воде, они образуют ионы водорода (H⁺) и отрицательно заряженные кислотные остатки. Заряд кислотного остатка равен числу атомов водорода, которые отщепились.
Степень окисления (с.о.): Это условный заряд атома в соединении, если бы все связи были ионными. Существуют правила для определения степени окисления:
- Сумма степеней окисления всех атомов в нейтральной молекуле равна нулю.
- Сумма степеней окисления всех атомов в ионе равна заряду этого иона.
- Водород (H) в соединениях с неметаллами обычно имеет с.о. +1.
- Кислород (O) в большинстве соединений имеет с.о. -2 (исключения: пероксиды -1, надпероксиды -1/2, фторид кислорода OF₂ +2).
Давайте применим эти правила к каждой кислоте:
HNO₃ (Азотная кислота):
Заряды ионов: При диссоциации HNO₃ отдает один ион H⁺. Следовательно, кислотный остаток NO₃ имеет заряд -1.
H⁺NO₃⁻
Степени окисления элементов:
H = +1
O = -2
Пусть с.о. азота (N) будет x.
(+1) + x + 3*(-2) = 0
1 + x — 6 = 0
x — 5 = 0 => x = +5
Таким образом: H⁺N⁺⁵O⁻²₃
H₂SO₄ (Серная кислота):
Заряды ионов: При диссоциации H₂SO₄ может отдать два иона H⁺. Следовательно, кислотный остаток SO₄ имеет заряд -2.
H⁺₂SO₄⁻²
Степени окисления элементов:
H = +1
O = -2
Пусть с.о. серы (S) будет x.
2*(+1) + x + 4*(-2) = 0
2 + x — 8 = 0
x — 6 = 0 => x = +6
Таким образом: H⁺₂S⁺⁶O⁻²₄
H₃PO₄ (Фосфорная кислота):
Заряды ионов: При диссоциации H₃PO₄ может отдать три иона H⁺. Следовательно, кислотный остаток PO₄ имеет заряд -3.
H⁺₃PO₄⁻³
Степени окисления элементов:
H = +1
O = -2
Пусть с.о. фосфора (P) будет x.
3*(+1) + x + 4*(-2) = 0
3 + x — 8 = 0
x — 5 = 0 => x = +5
Таким образом: H⁺₃P⁺⁵O⁻²₄
Итоговая таблица:
| Соединение | Заряды ионов | С.о. элементов |
|---|---|---|
| HNO₃ | H⁺NO₃⁻ | H⁺N⁺⁵O⁻²₃ |
| H₂SO₄ | H⁺₂SO₄⁻² | H⁺₂S⁺⁶O⁻²₄ |
| H₃PO₄ | H⁺₃PO₄⁻³ | H⁺₃P⁺⁵O⁻²₄ |
Вопрос 5
Задача: Установить соответствие между опасной ситуацией (попадание кислоты/щелочи на кожу) и необходимыми действиями по оказанию первой помощи во избежание химического ожога.
Химические ожоги требуют немедленной и правильной первой помощи, чтобы минимизировать повреждение тканей. Основной принцип — как можно быстрее удалить или нейтрализовать химическое вещество.
Общий первый шаг для ЛЮБОГО химического ожога:
1. Смыть химические растворы большим количеством воды: Это самое главное и первое действие. Обильное промывание проточной водой (под краном или душем) в течение 15-30 минут (а иногда и дольше) помогает:
- Разбавить химическое вещество, уменьшая его концентрацию.
- Механически удалить вещество с поверхности кожи.
- Охладить место ожога, уменьшая боль и предотвращая дальнейшее проникновение.
Важно: Нельзя использовать тонкую струю воды под давлением, чтобы не повредить кожу.
Дальнейшие действия (нейтрализация) зависят от типа вещества:
А) При попадании кислот на кожу:
После обильного промывания водой, необходимо нейтрализовать остатки кислоты. Для этого используют слабые растворы щелочей.
2) Промыть место ожога слабым раствором питьевой соды (NaHCO₃): Питьевая сода является слабой щелочью и эффективно нейтрализует кислоту, не вызывая при этом сильной экзотермической реакции, которая могла бы усугубить ожог.
Почему не сильная щелочь?
Использование сильной щелочи (например, NaOH) для нейтрализации кислоты может привести к сильному выделению тепла и вызвать новый химический ожог, на этот раз щелочной.
Б) При попадании щелочей на кожу:
После обильного промывания водой, необходимо нейтрализовать остатки щелочи. Для этого используют слабые растворы кислот.
3) Промыть место ожога раствором борной кислоты или слабым раствором уксусной кислоты: Борная кислота (H₃BO₃) и уксусная кислота (CH₃COOH) являются слабыми кислотами. Они способны нейтрализовать щелочь, не вызывая при этом сильной экзотермической реакции.
Почему не сильная кислота?
Аналогично случаю с кислотами, использование сильной кислоты (например, HCl или H₂SO₄) для нейтрализации щелочи может вызвать сильное выделение тепла и привести к новому химическому ожогу, на этот раз кислотному.
Итоговое соответствие:
| А | Б |
|---|---|
| 1,2 | 1,3 |

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.





Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!