
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страницы 96-97 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
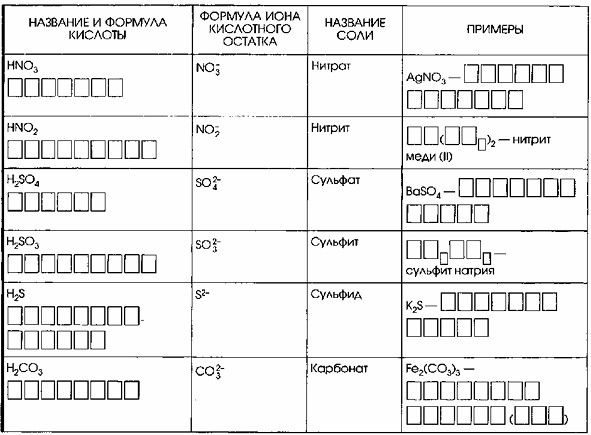
3. Дополните таблицу «Кислоты».
Вопрос 3
Кислоты
| Название и формула кислоты | Формула иона кислотного остатка | Название соли | Примеры |
| HNO₃ АЗОТНАЯ | NO₃⁻ | Нитрат | AgNO₃ НИТРАТ СЕРЕБРА |
| HNO₂ АЗОТИСТАЯ | NO₂⁻ | Нитрит | Cu(NO₂)₂ нитрит меди (II) |
| H₂SO₄ СЕРНАЯ | SO₄²⁻ | Сульфат | BaSO₄ СУЛЬФАТ БАРИЯ |
| H₂SO₃ СЕРНИСТАЯ | SO₃²⁻ | Сульфит | Na₂SO₃ сульфит натрия |
| H₂S СЕРОВОДОРОДНАЯ | S²⁻ | Сульфид | K₂S СУЛЬФИД КАЛИЯ |
| H₂CO₃ УГОЛЬНАЯ | CO₃²⁻ | Карбонат | Fe₂(CO₃)₃ КАРБОНАТ ЖЕЛЕЗА (III) |
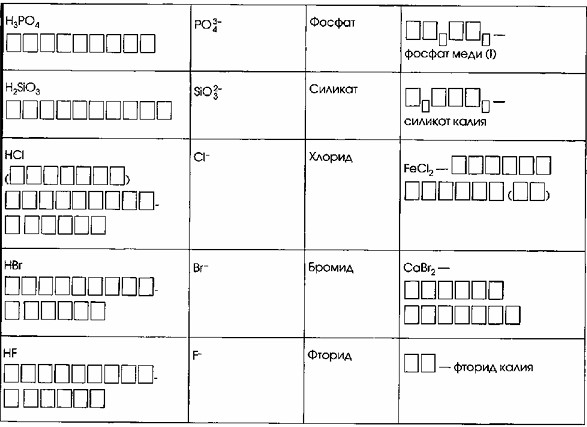
| H₃PO₄ ФОСФОРНАЯ | PO₄³⁻ | Фосфат | Cu₃PO₄ фосфат меди (I) |
| H₂SiO₃ КРЕМНИЕВАЯ | SiO₃²⁻ | Силикат | K₂SiO₃ Силикат калия |
| HCl СОЛЯНАЯ (СЕРОВОДОРОДНАЯ) | Cl⁻ | Хлорид | FeCl₂ ХЛОРИД ЖЕЛЕЗА (II) |
| HBr БРОМОВОДОРОДНАЯ | Br⁻ | Бромид | CaBr₂ БРОМИД КАЛЬЦИЯ |
| HF ФТОРОВОДОРОДНАЯ | F⁻ | Фторид | KF Фторид калия |
Вопрос 3
Для выполнения задания необходимо заполнить пустые ячейки в таблице.
Таблица содержит информацию о кислотах, их кислотных остатках, соответствующих солях и примерах этих солей. Заполнение таблицы основано на знании химических формул и номенклатуры неорганических соединений.
Основные химические принципы, используемые при заполнении:
1. Определение кислоты: Соединение, которое при диссоциации в воде образует ионы водорода (H⁺) и кислотный остаток (анион).
2. Образование кислотного остатка: Кислотный остаток образуется, когда кислота теряет все свои ионы водорода. Заряд кислотного остатка соответствует количеству потерянных ионов водорода.
3. Номенклатура кислот:
Бескислородные кислоты (состоят из водорода и неметалла, например, HCl, H₂S): Название образуется от названия неметалла с добавлением суффикса «-водородная» или «гидро-» и окончания «-ная» (например, хлороводородная, бромоводородная, сероводородная). Для некоторых существуют тривиальные названия (HCl — соляная).
Кислородсодержащие кислоты (состоят из водорода, неметалла и кислорода, например, H₂SO₄, HNO₃): Название образуется от названия неметалла, часто с суффиксами «-ная» (для высшей степени окисления неметалла) или «-истая» (для низшей степени окисления).
4. Номенклатура кислотных остатков (анионов):
От бескислородных кислот: название неметалла с суффиксом «-ид» (например, Cl⁻ — хлорид, S²⁻ — сульфид).
От кислородсодержащих кислот:
Если кислота оканчивается на «-ная», то кислотный остаток оканчивается на «-ат» (например, SO₄²⁻ — сульфат от H₂SO₄ серной).
Если кислота оканчивается на «-истая», то кислотный остаток оканчивается на «-ит» (например, SO₃²⁻ — сульфит от H₂SO₃ сернистой).
5. Номенклатура солей: Соль состоит из катиона металла (или аммония) и аниона кислотного остатка. Название соли образуется как «Название катиона» + «Название кислотного остатка». Если металл имеет переменную валентность, то валентность указывается римскими цифрами в скобках после названия металла (например, железо (II), медь (I)).
6. Составление формул солей: Сумма зарядов катионов должна быть равна сумме зарядов анионов, чтобы молекула была электронейтральной.
Пошаговое заполнение таблицы:
Рассмотрим каждую строку, объясняя логику заполнения каждой ячейки.
Строка 1:
Дано: HNO₃ (формула кислоты), NO₃⁻ (формула иона кислотного остатка), Нитрат (название соли), AgNO₃ (пример соли).
Заполняемые поля: Название кислоты, название примера соли.
Логика заполнения:
Название кислоты (HNO₃): Это кислородсодержащая кислота, азот в ней проявляет высшую степень окисления (+5). Следовательно, она называется АЗОТНАЯ.
Название примера соли (AgNO₃): Ag – это серебро. NO₃⁻ – это нитрат-ион. Таким образом, соль называется НИТРАТ СЕРЕБРА.
Строка 2:
Дано: HNO₂ (формула кислоты), NO₂⁻ (формула иона кислотного остатка), Нитрит (название соли), а также неполная формула и полное название нитрит меди (II) в столбце «Примеры».
Заполняемые поля: Название кислоты, а также заполнение пустых ячеек в формуле соли в столбце «Примеры».
Логика заполнения:
Название кислоты (HNO₂): В HNO₂ азот имеет степень окисления +3, что ниже, чем в HNO₃.
Следовательно, она называется АЗОТИСТАЯ.
Заполнение формулы соли в столбце «Примеры»:
Дано название: нитрит меди (II).
«Медь (II)» указывает на ион меди с зарядом +2 (Cu²⁺).
«Нитрит» указывает на нитрит-ион (NO₂⁻).
Чтобы сбалансировать заряды (Cu²⁺ и NO₂⁻), требуется один ион Cu²⁺ и два иона NO₂⁻.
Следовательно, полная формула соли будет Cu(NO₂)₂.
Пустые ячейки должны быть заполнены следующим образом:
Первые две ячейки: Cu
Ячейки в скобках: NO₂
Таким образом, для строки 2:
Название кислоты: АЗОТИСТАЯ
Пример соли: Cu(NO₂)₂ (где Cu и NO₂ заполняют пустые ячейки), и название нитрит меди (II) уже дано.
Строка 3:
Дано: H₂SO₄ (формула кислоты), SO₄²⁻ (формула иона кислотного остатка), Сульфат (название соли), BaSO₄ (пример соли).
Заполняемые поля: Название кислоты, название примера соли.
Логика заполнения:
Название кислоты (H₂SO₄): Сера в этой кислоте проявляет высшую степень окисления (+6). Следовательно, она называется СЕРНАЯ.
Название примера соли (BaSO₄): Ba – это барий. SO₄²⁻ – это сульфат-ион (заряд -2). Барий – элемент II группы, всегда имеет заряд +2. Заряды +2 и -2 сбалансированы. Таким образом, это СУЛЬФАТ БАРИЯ.
Строка 4:
Дано: H₂SO₃ (формула кислоты), SO₃²⁻ (формула иона кислотного остатка), Сульфит (название соли), а также неполная формула и полное название сульфит натрия в столбце «Примеры».
Заполняемые поля: Название кислоты, а также заполнение пустых ячеек в формуле соли в столбце «Примеры».
Логика заполнения:
Название кислоты (H₂SO₃): Сера в этой кислоте проявляет степень окисления +4, что ниже, чем в H₂SO₄.
Следовательно, она называется СЕРНИСТАЯ.
Заполнение формулы соли в столбце «Примеры»:
Дано название: сульфит натрия.
«Натрий» указывает на ион натрия с зарядом +1 (Na⁺).
«Сульфит» указывает на сульфит-ион (SO₃²⁻).
Чтобы сбалансировать заряды (2 x Na⁺ и SO₃²⁻), требуется два иона Na⁺ и один ион SO₃²⁻.
Следовательно, полная формула соли будет Na₂SO₃.
Пустые ячейки должны быть заполнены следующим образом:
Na₂SO₃
Таким образом, для строки 4:
Название кислоты: СЕРНИСТАЯ
Пример соли: Na₂SO₃ (где Na₂SO₃ заполняет пустые ячейки), и название сульфит натрия уже дано.
Строка 5:
Дано: H₂S (формула кислоты), S²⁻ (формула иона кислотного остатка), Сульфид (название соли), K₂S (пример соли).
Заполняемые поля: Название кислоты, название примера соли.
Логика заполнения:
Название кислоты (H₂S): Это бескислородная кислота. Название образуется от неметалла «сера» с добавлением «-водородная». Следовательно, это СЕРОВОДОРОДНАЯ.
Название примера соли (K₂S): K – это калий. S²⁻ – это сульфид-ион (заряд -2). Калий – элемент I группы, всегда имеет заряд +1. Для баланса заряда -2 требуется два иона калия (2 * +1 = +2). Таким образом, это СУЛЬФИД КАЛИЯ.
Строка 6:
Дано: H₂CO₃ (формула кислоты), CO₃²⁻ (формула иона кислотного остатка), Карбонат (название соли), Fe₂(CO₃)₃ (пример соли).
Заполняемые поля: Название кислоты, название примера соли.
Логика заполнения:
Название кислоты (H₂CO₃): Это кислота, содержащая углерод. Её тривиальное название – УГОЛЬНАЯ.
Название примера соли (Fe₂(CO₃)₃): Fe – это железо. CO₃²⁻ – это карбонат-ион (заряд -2). В формуле три карбонат-иона, общий отрицательный заряд 3 * (-2) = -6. В формуле два атома железа. Чтобы общий положительный заряд был +6, каждый атом железа должен иметь заряд +3 (2 * +3 = +6). Таким образом, это КАРБОНАТ ЖЕЛЕЗА (III).
Строка 7:
Дано: H₃PO₄ (формула кислоты), PO₄³⁻ (формула иона кислотного остатка), Фосфат (название соли), а также неполная формула и полное название фосфат меди (I) в столбце «Примеры».
Заполняемые поля: Название кислоты, а также заполнение пустых ячеек в формуле соли в столбце «Примеры».
Логика заполнения:
Название кислоты (H₃PO₄): Это кислота, содержащая фосфор.
Её название – ФОСФОРНАЯ.
Заполнение формулы соли в столбце «Примеры»:
Дано название: фосфат меди (I).
«Медь (I)» указывает на ион меди с зарядом +1 (Cu⁺).
«Фосфат» указывает на фосфат-ион (PO₄³⁻).
Чтобы сбалансировать заряды (3 x Cu⁺ и PO₄³⁻), требуется три иона Cu⁺ и один ион PO₄³⁻.
Следовательно, полная формула соли будет Cu₃PO₄.
Пустые ячейки должны быть заполнены следующим образом:
Cu в первых скобках, PO₄ во вторых скобках.
Таким образом, для строки 7:
Название кислоты: ФОСФОРНАЯ
Пример соли: Cu₃PO₄ (где Cu и PO₄ заполняют пустые ячейки), и название фосфат меди (I) уже дано.
Строка 8:
Дано: H₂SiO₃ (формула кислоты), SiO₃²⁻ (формула иона кислотного остатка), Силикат (название соли), а также неполная формула и полное название силикат калия в столбце «Примеры».
Заполняемые поля: Название кислоты, а также заполнение пустых ячеек в формуле соли в столбце «Примеры».
Логика заполнения:
Название кислоты (H₂SiO₃):
Это кислота, содержащая кремний.
Её название – КРЕМНИЕВАЯ.
Заполнение формулы соли в столбце «Примеры»:
Дано название: силикат калия.
«Калий» указывает на ион калия с зарядом +1 (K⁺).
«Силикат» указывает на силикат-ион (SiO₃²⁻), который является кислотным остатком от H₂SiO₃.
Чтобы сбалансировать заряды (K⁺ и SiO₃²⁻), требуется два иона K⁺ для каждого иона SiO₃²⁻.
Следовательно, полная формула соли будет K₂SiO₃.
Таким образом, для строки с H₂SiO₃:
Название кислоты: КРЕМНИЕВАЯ
Пример соли: K₂SiO₃ (где K₂SiO₃ заполняет место для формулы), и название силикат калия уже дано.
Строка 9:
Дано: HCl (формула кислоты), Cl⁻ (формула иона кислотного остатка), Хлорид (название соли), FeCl₂ (пример соли).
Заполняемые поля: Название кислоты, название примера соли.
Логика заполнения:
Название кислоты (HCl): Это бескислородная кислота. Её систематическое название – хлороводородная, но чаще используется тривиальное – СОЛЯНАЯ.
Название примера соли (FeCl₂): Fe – это железо. Cl⁻ – это хлорид-ион (заряд -1). В формуле два хлорид-иона, общий отрицательный заряд 2 * (-1) = -2. Для баланса железо должно иметь заряд +2. Таким образом, это ХЛОРИД ЖЕЛЕЗА (II).
Строка 10:
Дано: HBr (формула кислоты), Br⁻ (формула иона кислотного остатка), Бромид (название соли), CaBr₂ (пример соли).
Заполняемые поля: Название кислоты, название примера соли.
Логика заполнения:
Название кислоты (HBr): Это бескислородная кислота. Название образуется от неметалла «бром» с добавлением «-водородная». Следовательно, это БРОМОВОДОРОДНАЯ.
Название примера соли (CaBr₂): Ca – это кальций. Br⁻ – это бромид-ион (заряд -1). Кальций – элемент II группы, всегда имеет заряд +2. Для баланса заряда +2 требуется два бромид-иона (2 * -1 = -2). Таким образом, это БРОМИД КАЛЬЦИЯ.
Строка 11:
Столбец 1: Название и формула кислоты (Название кислоты)
Дано: Формула HF.
Задание: Указать название кислоты.
Решение: Кислота HF называется ФТОРОВОДОРОДНАЯ. Это название также известно как плавиковая кислота.
Столбец 4: Примеры (Формула соли)
Дано: Пустые ячейки — фторид калия.
Задание: Заполнить пустые ячейки формулой соли «фторид калия».
Логика заполнения формулы:
Определяем ионы:
«Калия» указывает на калий (K). Калий находится в первой группе периодической системы, поэтому его ион имеет заряд +1 (K⁺).
«Фторид» указывает на фтор (F), который является кислотным остатком от HF. Его ион имеет заряд -1 (F⁻).
Сбалансируем заряды: У нас есть K⁺ и F⁻. Заряды уже сбалансированы (+1 и -1).
Составляем формулу: Для образования нейтрального соединения требуется один ион K⁺ и один ион F⁻.
Формула соли: KF.
Решение: В пустые ячейки следует вписать KF.
Итоговое заполнение:
Название и формула кислоты: HF ФТОРОВОДОРОДНАЯ
Примеры: KF — фторид калия
Таким образом, процесс решения заключается в применении правил химической номенклатуры и знаний о валентностях/степенях окисления элементов для каждой конкретной химической формулы или названия, что позволяет заполнить недостающие данные в соответствии с логикой химических связей и наименований.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.





Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!