
Учебник О.С. Габриеляна — одно из лучших пособий для изучения химии в 8-м классе. Материал изложен доступно, логично структурирован и дополнен красочными иллюстрациями, что делает обучение увлекательным и понятным.
ГДЗ по Химии 8 Класс Лабораторная работа 4 Базовый Уровень Габриелян — Подробные Ответы
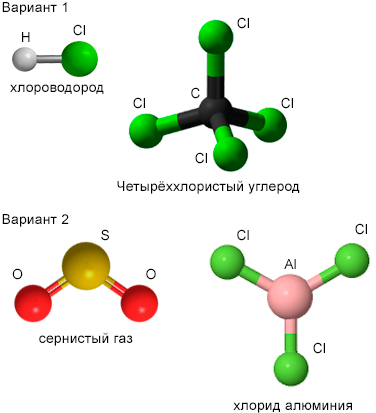
Используя шаростержневые наборы, соберите модели молекул следующих веществ:
вариант 1 — хлороводорода HCl, четырёххлористого углерода CCl₄;
вариант 2 — сернистого газа SO₂, хлорида алюминия AlCl₃.
Вариант 1: Хлороводород (HCl) и четырёххлористый углерод (CCl₄)
1. Молекула хлороводорода (HCl):
— Структура: Молекула HCl состоит из одного атома водорода (H) и одного атома хлора (Cl), соединённых ковалентной полярной связью.
— Сборка:
- Возьмите один шар, обозначающий атом водорода (обычно маленький, белый).
- Соедините его с шаром, представляющим атом хлора (большой, зелёный), с помощью одного стержня.
— Форма молекулы: Линейная, так как состоит из двух атомов.
2. Молекула четырёххлористого углерода (CCl₄):
— Структура: Молекула CCl₄ имеет центральный атом углерода (C), связанный с четырьмя атомами хлора (Cl) с помощью ковалентных связей.
— Сборка:
- Возьмите один шар, обозначающий атом углерода (обычно чёрный или серый).
- Соедините его с четырьмя шарами, обозначающими атомы хлора (зелёные), используя четыре стержня.
- Расположите атомы хлора так, чтобы они находились на равных расстояниях друг от друга, формируя тетраэдрическую форму.
— Форма молекулы: Тетраэдрическая.
Вариант 2: Сернистый газ (SO₂) и хлорид алюминия (AlCl₃)
1. Молекула сернистого газа (SO₂):
— Структура: Молекула SO₂ состоит из одного атома серы (S) и двух атомов кислорода (O). Сера образует две двойные связи с атомами кислорода, при этом молекула имеет угловую форму из-за наличия неподелённой электронной пары на сере.
— Сборка:
- Возьмите один шар для атома серы (обычно жёлтый).
- Соедините его с двумя шарами для атомов кислорода (красные) с использованием двойных стержней.
- Расположите атомы кислорода под углом около 120°, чтобы отразить угловую форму молекулы.
— Форма молекулы: Угловая.
2. Молекула хлорида алюминия (AlCl₃):
— Структура: Молекула AlCl₃ состоит из одного атома алюминия (Al) и трёх атомов хлора (Cl). Алюминий образует три ковалентные связи с хлором, и молекула имеет плоскую треугольную форму.
— Сборка:
- Возьмите один шар для атома алюминия (обычно серебристый или серый).
- Соедините его с тремя шарами для атомов хлора (зелёные) с помощью трёх стержней.
- Расположите атомы хлора в одной плоскости под углом 120° друг к другу.
— Форма молекулы: Плоская треугольная.
Итог
При сборке моделей важно учитывать тип связей (одинарные, двойные) и геометрическую форму молекул, которая определяется их электронной структурой. Используя шаростержневые наборы, можно визуализировать пространственное расположение атомов и понять особенности строения данных веществ.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.





Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!