
Учебник «Химия» для 8-го класса, написанный Габриеляном и Остроумовым, представляет собой качественное учебное пособие, которое помогает школьникам погрузиться в мир химии и освоить ее основные понятия. Книга отличается доступным языком изложения, продуманной структурой и ярким оформлением, что делает процесс изучения увлекательным и понятным.
ГДЗ по Химии 8 Класс Параграф 20 Вопрос 4 Габриелян, Остроумов — Подробные Ответы
Не производя письменных вычислений, укажите, какой объём углекислого газа и какое количество вещества негашёной извести СаО образуется при обжиге 2 моль карбоната кальция. Уравнение реакции:
\( \text{CaCO}_3 = \text{CaO} + \text{CO}_2 \)
\( n(\text{CaCO}_3) = n(\text{CaO}) = n(\text{CO}_2) = 2 \text{ моль} \)
\( V(\text{CO}_2) = n \cdot V_m = 2 \cdot 22,4 = 44,8 \text{ (л)} \)
1. Анализ химического уравнения:
Нам дано уравнение реакции: \( \text{CaCO}_3 = \text{CaO} + \text{CO}_2 \uparrow \)
Это уравнение показывает процесс термического разложения карбоната кальция (\(\text{CaCO}_3\)) на оксид кальция (\(\text{CaO}\), негашёная известь) и углекислый газ (\(\text{CO}_2\)).
Важно обратить внимание на стехиометрические коэффициенты перед каждым веществом. В данном уравнении перед всеми формулами стоит неявный коэффициент «1». Это означает, что 1 моль карбоната кальция разлагается с образованием 1 моля оксида кальция и 1 моля углекислого газа.
2. Определение количества вещества продуктов:
Нам дано, что обжигу подвергается 2 моль карбоната кальция
(\( n(\text{CaCO}_3) = 2 \text{ моль} \)).
Исходя из стехиометрии реакции (соотношение 1:1:1), если в реакцию вступает 2 моль \( \text{CaCO}_3 \), то:
- Количество вещества негашёной извести (\(\text{CaO}\)) будет таким же, как количество исходного карбоната кальция, то есть \( n(\text{CaO}) = 2 \text{ моль} \).
- Количество вещества углекислого газа (\(\text{CO}_2\)) также будет равно количеству исходного карбоната кальция, то есть \( n(\text{CO}_2) = 2 \text{ моль} \).
Таким образом, мы уже определили количество вещества негашёной извести: 2 моль.
3. Расчет объёма углекислого газа:
Для расчета объема газа нам нужно знать его количество вещества и молярный объем. При нормальных условиях (н.у.), молярный объем любого газа составляет \( 22,4 \text{ л/моль} \). Хотя в задании не указаны нормальные условия, в школьных задачах по химии, если не указано иное, расчеты объема газов подразумевают именно их.
Мы определили, что образуется 2 моль \( \text{CO}_2 \).
Формула для расчета объема газа: \( V = n \cdot V_m \), где \( n \) — количество вещества, а \( V_m \) — молярный объем.
Подставляем значения:
\( V(\text{CO}_2) = 2 \text{ моль} \cdot 22,4 \text{ л/моль} \)
\( V(\text{CO}_2) = 44,8 \text{ л} \)
Итоговый ответ:
Количество вещества негашёной извести (\(\text{CaO}\)): 2 моль
Объём углекислого газа (\(\text{CO}_2\)): 44,8 л (если использовать стандартный молярный объем 22,4 л/моль).

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.


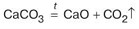



Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!