
Учебник «Химия» для 8-го класса, написанный Габриеляном и Остроумовым, представляет собой качественное учебное пособие, которое помогает школьникам погрузиться в мир химии и освоить ее основные понятия. Книга отличается доступным языком изложения, продуманной структурой и ярким оформлением, что делает процесс изучения увлекательным и понятным.
ГДЗ по Химии 8 Класс Параграф 34 Вопрос 6 Габриелян, Остроумов — Подробные Ответы
Учебник 2023
Предложите свой вариант графического отображения образования химической связи в соединении, имеющем формулу BaCl₂.
Учебник 2019
Предложите свой вариант графического отображения образования химической связи в соединении, имеющем формулу CaF₂.
Учебник 2023
Учебник 2019
Учебник 2023
ОБРАЗОВАНИЕ ИОННОЙ СВЯЗИ В ХЛОРИДЕ БАРИЯ
Процесс формирования химической связи в данном соединении можно разбить на несколько фундаментальных этапов, каждый из которых объясняет, почему итоговая формула выглядит именно как BaCl₂.
1. ХАРАКТЕРИСТИКА АТОМА БАРИЯ
Барий — это типичный металл, расположенный во второй группе периодической системы. Согласно строению его атома, на самом внешнем электронном слое у него находятся два валентных электрона. Эти электроны слабо связаны с ядром. Для того чтобы обрести энергетическую устойчивость (состояние с полностью заполненным внешним слоем, как у благородного газа ксенона), барию необходимо полностью отдать эти два электрона.
2. ХАРАКТЕРИСТИКА АТОМА ХЛОРА
Хлор — это активный неметалл из седьмой группы. На его внешнем слое находится семь электронов. До заветной восьмерки (октета), которая обеспечивает атому максимальную стабильность, ему не хватает всего одного электрона. Поэтому каждый атом хлора стремится захватить один чужой электрон, чтобы заполнить свою электронную оболочку.
3. МЕХАНИЗМ ПЕРЕДАЧИ ЭЛЕКТРОНОВ
Когда атом бария взаимодействует с хлором, происходит перераспределение зарядов:
— Атом бария начинает отдавать свои два валентных электрона.
— Однако один атом хлора может принять только один электрон.
— Следовательно, чтобы принять оба электрона от одного атома бария, требуется ровно два атома хлора.
В результате этого обмена барий превращается в положительно заряженный ион (катион) с зарядом 2+, а каждый из двух атомов хлора становится отрицательно заряженным ионом (анионом) с зарядом 1-.
4. ФОРМИРОВАНИЕ ИОННОЙ СВЯЗИ
После передачи электронов частицы перестают быть нейтральными атомами и превращаются в ионы. Между положительно заряженным барием и двумя отрицательно заряженными ионами хлора возникают мощные силы электростатического притяжения. Именно эти силы удерживают ионы вместе, образуя прочное химическое соединение.
5. ЛОГИКА ГРАФИЧЕСКОЙ СХЕМЫ
Графическое отображение последовательно раскрывает динамику превращения нейтральных атомов в заряженные частицы и их последующее объединение в устойчивую структуру. Схема разделена на две смысловые части: горизонтальную цепочку превращений и вертикальный баланс электронных переходов.
Ниже приведено детальное описание каждого элемента этой графики
Верхняя горизонтальная схема процесса
1. Исходное состояние (левая часть): Изображены три независимых объекта — один атом бария (Ba) и два атома хлора (Cl). Подписи Атом подтверждают, что в этот момент частицы не имеют заряда и электрически нейтральны.
2. Динамика переноса (изогнутые стрелки): От центрального атома бария к каждому из боковых атомов хлора проведены стрелки. Над ними стоит символ e с чертой, обозначающий электрон. Это визуализирует акт передачи отрицательного заряда. Две стрелки указывают на то, что барий расстается с двумя электронами одновременно, распределяя их между двумя партнерами.
3. Стадия ионизации (центральная часть после первой стрелки): Здесь показан результат обмена. Атом бария превратился в ион Ba с верхним индексом 2+, что означает потерю двух отрицательных частиц. Атомы хлора превратились в ионы Cl с индексом минус. Коэффициент 2 перед хлором указывает на то, что теперь мы имеем дело с двумя отдельными отрицательными частицами.
4. Формирование соединения (правая часть): Конечная стрелка ведет к записи BaCl₂. Это ионное соединение, где частицы уже не просто существуют рядом, а связаны электростатическим притяжением в единую структуру.
Вертикальный блок электронных уравнений
1. Центральное уравнение для бария: Запись Ba — 2e = Ba(2+) графически поясняет химическую природу металла. Ноль над символом Ba в левой части уравнения подчеркивает исходную нейтральность, а знак минус перед электронами показывает их уход из электронной оболочки атома.
2. Симметричные уравнения для хлора: Сверху и снизу от бария расположены идентичные записи Cl + e = Cl(-). Это сделано для того, чтобы показать индивидуальную роль каждого атома хлора. Графика подчеркивает: один хлор не может забрать оба электрона у бария, поэтому в процессе обязательно участвуют две единицы неметалла.
3. Красные связующие стрелки: Вертикальные двусторонние стрелки красного цвета объединяют процессы отдачи и принятия электронов в общую систему. Они наглядно демонстрируют закон сохранения заряда: сколько электронов было отдано металлом, столько же в сумме было принято неметаллами.
Визуальные обозначения и символика
1. Цветовое кодирование: Использование разных цветов для сфер (серый для бария и красноватый для хлора) помогает быстро отличить катион металла от аниона неметалла.
2. Индексы и заряды: Математические символы (плюсы, минусы и цифры в верхних и нижних регистрах) в графике служат для точного количественного учета. Верхний индекс (2+) всегда обозначает заряд иона, а нижний индекс в итоговой формуле (2 в BaCl₂) — количество этих ионов в составе вещества.
Такое графическое представление позволяет проследить путь каждой элементарной частицы и понять, почему химическая формула вещества имеет именно такой вид, основываясь на электронном строении участвующих элементов.
Таким образом, ионная связь в хлориде бария — это результат полного перехода электронов от металла к неметаллу, превращающий их в разноименно заряженные частицы, которые удерживаются вместе силами электрического притяжения. Суммарный заряд получившегося соединения всегда равен нулю, что делает его стабильным.
Учебник 2019
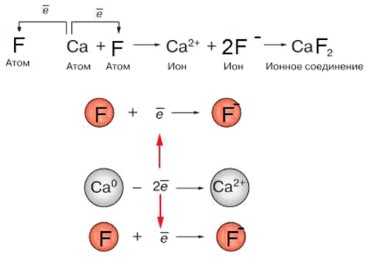
Процесс образования химической связи в соединении CaF₂ (фторид кальция) представляет собой классический механизм возникновения ионной связи. На представленной схеме этот процесс визуализирован через поэтапную передачу электронов от активного металла к активному неметаллу.
Ниже приведено подробное описание графических элементов и логики построения данной схемы.
Общая логика процесса
В основе взаимодействия лежит стремление атомов к достижению устойчивой электронной оболочки. Кальций (Ca) находится во второй группе и имеет 2 лишних электрона на внешнем слое. Фтор (F) находится в седьмой группе, и ему не хватает всего 1 электрона до завершения слоя. Таким образом, один атом кальция становится «донором» для двух атомов фтора.
Графическое представление разделено на две дополняющие друг друга части: динамическую последовательность превращений и детальный баланс зарядов.
1. Горизонтальная схема превращений
Верхняя часть изображения демонстрирует путь трансформации вещества слева направо:
— Стадия атомов: Слева изображены нейтральные частицы с подписью «Атом». В центре находится Ca, по бокам от него — два атома F. Это подчеркивает пространственную логику: кальций отдает электроны в обе стороны.
— Стрелки переноса электронов: Изогнутые стрелки, идущие от кальция к фтору с пометкой ē, наглядно показывают физический переход отрицательного заряда. Это ключевой визуальный элемент, объясняющий причину изменения свойств частиц.
— Стадия ионов: После первой стрелки превращения мы видим ионы. Кальций приобрел заряд 2+, а фтор — заряд минус. Коэффициент «2» перед фтором указывает на количественное сохранение материи.
— Итоговое соединение: Завершается схема формулой CaF₂, где индексы показывают результат электростатического притяжения разноименно заряженных частиц.
2. Вертикальный блок электронных уравнений
Нижняя часть схемы детализирует математическую сторону процесса:
— Уравнение для кальция: В центре расположена запись Ca⁰ — 2ē → Ca²⁺. Ноль в верхнем индексе обозначает нейтральный атом, а знак минус перед электронами акцентирует внимание на их потере.
— Уравнения для фтора: Сверху и снизу симметрично расположены записи F + ē → F⁻. Такое дублирование графически обосновывает, почему в формуле CaF₂ стоит индекс «2»: один атом фтора физически не способен принять оба электрона от кальция.
— Красные связующие стрелки: Вертикальные двусторонние стрелки красного цвета соединяют процессы отдачи и принятия. Это визуальный символ закона сохранения заряда: количество отданных электронов строго равно количеству принятых.
Для понимания графики важно учитывать значение каждого символа и цвета.
1. Элемент графики: Серый круг (Ca).
Химический смысл: Катион металла.
Роль в схеме: Показывает центр положительного заряда.
2. Элемент графики: Красный круг (F).
Химический смысл: Анион неметалла.
Роль в схеме: Показывает носителей отрицательного заряда.
3. Элемент графики: Верхний индекс (2+, -).
Химический смысл: Заряд иона.
Роль в схеме: Демонстрирует приобретенную электрическую активность.
4. Элемент графики: Нижний индекс (₂ в CaF₂).
Химический смысл: Стехиометрия.
Роль в схеме: Указывает на количественное соотношение ионов в кристалле.
В результате такого графического построения становится очевидно, что ионная связь — это не просто запись формулы, а результат перемещения элементарных зарядов, приводящий к образованию электронейтральной и устойчивой системы. Глядя на схему, можно проследить судьбу каждого электрона: от момента его нахождения на орбитали кальция до перехода в оболочку фтора.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.






Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!