
Учебник «Химия» для 8-го класса, написанный Габриеляном и Остроумовым, представляет собой качественное учебное пособие, которое помогает школьникам погрузиться в мир химии и освоить ее основные понятия. Книга отличается доступным языком изложения, продуманной структурой и ярким оформлением, что делает процесс изучения увлекательным и понятным.
ГДЗ по Химии 8 Класс Параграф 37 Вопрос 6 Габриелян, Остроумов — Подробные Ответы
Запишите по одной схеме образования ионной, ковалентной полярной и неполярной, металлической связей для веществ, перечисленных в предыдущем задании.
а) поваренная соль NaCl:
б) серебро Ag:
Ag⁰ — e → Ag⁺
в) магний Mg:
\(Mg^0 — 2e \rightarrow Mg^{+2}\)
г) углекислый газ CO₂:
д) вода H₂O:
е) азот N₂:
Серебро Ag и магний (Mg) — металлическая связь
Для металлов мы записываем процесс превращения нейтрального атома в ион, который остается в кристаллической решетке.
1. Записываем символ элемента с нулевым зарядом вверху: \(Ag^0\) или \(Mg^0\). Это стартовая точка, когда атом еще не отдал свои электроны.
2. Показываем процесс отдачи внешних электронов через знак минус. Для серебра, которое находится в первой группе (побочной подгруппе), пишем \(- 1e\). Для магния из второй группы пишем \(- 2e\).
3. Ставим стрелку и записываем результат: положительно заряженный ион \(Ag^+\) или \(Mg^{+2}\). Эти электроны не уходят из куска металла, а становятся общими, образуя электронный газ.
Поваренная соль (NaCl) — ионная связь
Здесь мы фиксируем передачу электрона от металла к неметаллу.
1. Записываем два нейтральных атома: \(Na\) и \(Cl\). Можно представить, что у натрия на внешнем уровне один электрон, а у хлора — семь.
2. Рисуем стрелку, которая символизирует переход этого единственного внешнего электрона от натрия к хлору.
3. После стрелки записываем образовавшиеся ионы с их зарядами: \(Na^+\) и \(Cl^-\). Теперь они притягиваются друг к другу как магниты.
4. Завершаем схему записью готового соединения: \(NaCl\).
Углекислый газ \(CO_2\) — это прекрасный пример того, как атомы могут заключать взаимовыгодные союзы, создавая сразу несколько общих пар. В химии это называется двойной связью.
Углекислый газ (CO2) — ковалентная полярная связь
1. Определение количества электронов: Сначала мы смотрим на положение элементов в таблице Менделеева. Углерод (\(C\)) находится в 4 группе, значит, у него 4 внешних электрона (рисуем 4 точки вокруг символа). Кислород (\(O\)) находится в 6 группе, у него 6 внешних электронов, из которых 2 неспаренные (рисуем 6 точек, оставляя две из них одиночными).
2. Расстановка атомов: Чтобы достичь устойчивого состояния (8 электронов на уровне), углероду не хватает 4 электронов, а каждому кислороду — по 2. Поэтому углерод становится в центр, а два атома кислорода располагаются по бокам от него.
3. Создание двойных связей: Углерод выставляет по два своих электрона навстречу каждому кислороду. Кислороды, в свою очередь, тоже направляют свои неспаренные электроны к углероду. Таким образом, между углеродом и каждым кислородом образуется не одна, а сразу две общие электронные пары.
4. Запись итоговой структуры: После стрелки мы рисуем углерод, окруженный двумя парами точек с каждой стороны: 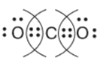
5. Учет полярности: Кислород сильнее притягивает электроны, чем углерод. Поэтому в схеме мы понимаем, что общие электронные пары смещены в сторону кислородов. На атомах кислорода возникает частичный отрицательный заряд, а на углероде — частичный положительный.
Интересно, что хотя сами связи между углеродом и кислородом полярные, вся молекула в целом получается симметричной и линейной. Это делает углекислый газ очень стабильным соединением, которое окружает нас повсюду.
Вода (H2O) — ковалентная полярная связь
В этом случае мы рисуем, как атомы делятся электронами, создавая общие пары.
1. Обозначаем атомы точками. У кислорода рисуем 6 точек (так как он в 6 группе), из которых две точки одиночные. У двух атомов водорода рисуем по одной точке.
2. Располагаем водороды по бокам от кислорода так, чтобы их одиночные точки находились напротив одиночных точек кислорода.
3. После стрелки объединяем точки в пары между символами элементов: 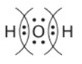
4. Поскольку кислород сильнее притягивает электроны, мысленно или стрелочкой помечаем, что эти пары смещены к символу \(O\).
Азот (N2) — ковалентная неполярная связь
Это пример того, как два одинаковых атома создают максимально прочный союз.
1. Рисуем два атома азота. У каждого по 5 точек (5 группа), при этом 3 точки у каждого — одиночные (неспаренные).
2. Ставим атомы друг напротив друга так, чтобы все три одиночных электрона одного атома смотрели на три одиночных электрона другого.
3. После стрелки объединяем их в три общие пары, которые рисуются строго посередине между символами:
4. Получившаяся тройная связь очень прочная, и так как атомы одинаковые, электроны распределены между ними абсолютно честно и равномерно.
Такая детальная запись помогает понять не только конечный результат, но и саму логику химического взаимодействия.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.



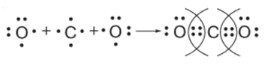
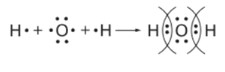
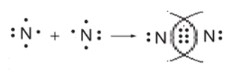




Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!