
Учебник «Химия» для 8-го класса, написанный Габриеляном и Остроумовым, представляет собой качественное учебное пособие, которое помогает школьникам погрузиться в мир химии и освоить ее основные понятия. Книга отличается доступным языком изложения, продуманной структурой и ярким оформлением, что делает процесс изучения увлекательным и понятным.
ГДЗ по Химии 8 Класс Практическая работа 4 Габриелян, Остроумов — Подробные Ответы
ПОЛУЧЕНИЕ, СОБИРАНИЕ И РАСПОЗНАВАНИЕ КИСЛОРОДА
Вариант 1
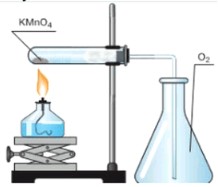
1. Работу начните со сборки прибора для получения газов и проверки его герметичности. Для этого используйте подготовленную учителем пробирку-реактор с перманганатом калия. Положите в неё небольшой ватный тампон как можно ближе к отверстию, чтобы пылевидное твердое вещество через газоотводную трубку не попало в сосуд-приёмник для кислорода.
(Собранный прибор поместите в ладонь, а конец газоотводной трубки опустите в воду. Согрейте пробирку ладонью.
Появление пузырьков воздуха указывает на герметичность прибора.
2. Закрепите пробирку-реактор с веществом в лабораторном штативе, регулируя её положение так, чтобы конец газоотводной трубки доходил до дна сосуда-приёмника для кислорода.
3. Зажгите спиртовку, прогрейте пробирку-реактор, равномерно перемещая спиртовку по всей её длине. Затем установите спиртовку под ту часть пробирки, где находится перманганат калия.
Нагрейте пробирку-реактор, собирая выделяющийся кислород вытеснением воздуха из сосуда. Почему кислород собирают именно так?
4. Приготовьте тлеющую лучинку. Проверьте наличие кислорода в сосуде. Для этого тлеющую лучинку опустите в сосуд. Что наблюдаете?
5. По окончании опыта погасите спиртовку и оформите отчёт по следующей форме:
| Что делал(а) | Что наблюдал(а) (сделайте рисунок, если необходимо) | Выводы и уравнения реакций |
|---|
Используйте эту форму и при выполнении других работ.
Вариант 2
1. Работу начните со сборки прибора для получения газов и проверки его герметичности. Для этого собранный прибор поместите в ладонь, а конец газоотводной трубки опустите в воду. Согрейте пробирку ладонью.
Появление пузырьков воздуха указывает на герметичность прибора.
2. Выньте пробку с газоотводной трубкой, налейте в пробирку 3—4 мл аптечного препарата перекиси водорода, добавьте небольшое количество оксида марганца(IV) (на кончике шпателя). Быстро закройте пробирку-реактор пробкой и конец газоотводной трубки опустите в сосуд-приёмник. Что наблюдаете?
3. Соберите выделяющийся кислород вытеснением воздуха из сосуда. Почему кислород собирают именно так?
4. Приготовьте тлеющую лучинку.
Проверьте наличие кислорода в сосуде. Для этого тлеющую лучинку опустите в сосуд. Что наблюдаете?
Какую роль в эксперименте играет оксид марганца(IV)?
По завершении работы оформите отчёт.
Вариант 1
| Что делали | Что наблюдали | Выводы и уравнения реакций |
|---|---|---|
| Собрали установку для получения газов: Нагрели пробирку с веществом | Появились пузырьки газа | Установка успешно проверена на герметичность |
| Закрепили пробирку в штативе, зажгли спиртовку. | Кислород начал собираться в приемный сосуд методом вытеснения воздуха | Кислород собирают таким способом, поскольку его плотность выше плотности воздуха (32>29). |
| Поднесли тлеющую лучинку к сосуду-приемнику | Лучинка ярко воспламенилась | Кислород поддерживает горение, поэтому воспламенение лучинки подтверждает его наличие. |
Вариант 2
| Что делал | Что наблюдал | Выводы и уравнения реакций |
|---|---|---|
| Собрали прибор для получения газов. Поместили собранный прибор в ладонь, а конец газоотводной трубки опустили в воду. Согрели пробирку ладонью. | Появление пузырьков воздуха. | Прибор герметичен. |
| Вынули пробку с газоотводной трубкой. Налили в пробирку 3—4 мл аптечного препарата перекиси водорода. Добавили небольшое количество оксида марганца(IV) (на кончике шпателя). Быстро закрыли пробирку-реактор пробкой и конец газоотводной трубки опустили в сосуд-приёмник. | Наблюдается интенсивное выделение газа (пузырьки). | Происходит реакция разложения перекиси водорода с образованием кислорода: 2H₂O₂ —(MnO₂)—> 2H₂O + O₂↑ |
| Собрали выделяющийся кислород методом вытеснения воздуха из сосуда. | Кислород собирают таким методом, так как он тяжелее воздуха (M(O₂) = 32 г/моль, M(воздуха) ≈ 29 г/моль). | |
| Приготовили тлеющую лучинку. Опустили тлеющую лучинку в сосуд с газом. | Лучинка вспыхнула. | Кислород поддерживает горение, что подтверждается вспыхиванием тлеющей лучинки. Оксид марганца(IV) (MnO₂) играет роль катализатора, ускоряя реакцию разложения перекиси водорода. |
Для выполнения лабораторной работы «Получение, собирание и распознавание кислорода» рассмотрим два варианта эксперимента, подробно объясняя каждый шаг, наблюдаемые явления и выводы.
Общее введение: Зачем мы это делаем?
Кислород (O₂) – это жизненно важный газ, который составляет около 21% атмосферы Земли. В лаборатории его часто получают путем разложения кислородсодержащих соединений. Цель этих экспериментов – не только получить кислород, но и научиться правильно его собирать (поскольку он невидим) и доказывать его наличие с помощью характерных химических свойств.
Вариант 1: Получение кислорода из перманганата калия (KMnO₄)
В этом варианте кислород получают термическим разложением перманганата калия, который является твердым веществом.
1. Сборка прибора и проверка его герметичности
Что делали:
- Сборка установки: Мы собираем специальный прибор, который состоит из пробирки-реактора (где будет происходить реакция), газоотводной трубки (для отвода газа) и сосуда-приёмника (для сбора газа). В пробирку-реактор помещается перманганат калия (KMnO₄), а также небольшой ватный тампон. Ватный тампон помещается ближе к отверстию пробирки, чтобы предотвратить попадание мелких частиц перманганата калия или продуктов его разложения в газоотводную трубку и далее в сосуд-приёмник, что могло бы загрязнить собранный кислород.
- Проверка герметичности: Это критически важный шаг перед началом любой работы с газами. Чтобы убедиться, что газ не будет утекать из установки, мы помещаем собранный прибор в ладонь (или слегка нагреваем пробирку) и опускаем конец газоотводной трубки в воду.
Что наблюдали:
Из конца газоотводной трубки, опущенного в воду, начинают появляться небольшие пузырьки газа.
Выводы и объяснение:
Принцип герметичности: Когда мы согреваем пробирку ладонью, воздух внутри пробирки нагревается. Согласно законам физики (закону Шарля), при нагревании газ расширяется.
Поскольку объем пробирки ограничен, расширяющийся воздух вынужден выходить через единственный доступный путь – газоотводную трубку. Если прибор герметичен, то есть все соединения плотные и нет утечек, то весь расширяющийся воздух будет выходить именно через трубку, образуя пузырьки в воде.
Значение: Появление пузырьков подтверждает, что прибор герметичен. Это означает, что в дальнейшем весь образующийся кислород будет эффективно собираться в сосуде-приёмнике, а не будет рассеиваться в воздухе.
2. Нагрев вещества и сбор газа
Что делали:
Закрепление и нагрев: Пробирка-реактор с перманганатом калия закрепляется в лабораторном штативе. Важно правильно отрегулировать положение, чтобы конец газоотводной трубки достигал дна сосуда-приёмника. Затем с помощью спиртовки пробирка равномерно прогревается по всей длине, чтобы избежать растрескивания стекла от резкого перепада температур. После этого пламя спиртовки фокусируется на той части пробирки, где находится перманганат калия.
Сбор кислорода: Выделяющийся кислород собирается методом вытеснения воздуха из сосуда.
Что наблюдали:
При нагревании перманганата калия наблюдается изменение цвета вещества (обычно фиолетовый KMnO₄ превращается в зеленовато-черный K₂MnO₄ и черный MnO₂). Из газоотводной трубки начинает интенсивно выделяться газ, который заполняет сосуд-приёмник.
Выводы и объяснение:
Химическая реакция: При нагревании перманганат калия (KMnO₄) разлагается, образуя манганат калия (K₂MnO₄), оксид марганца(IV) (MnO₂) и газообразный кислород (O₂). Эта реакция является термическим разложением.
Уравнение реакции: 2KMnO₄(тв) —(t°)—> K₂MnO₄(тв) + MnO₂(тв) + O₂(г)↑
Стрелка вверх (↑) указывает на выделение газа.
Метод сбора: Кислород собирают методом вытеснения воздуха, потому что кислород тяжелее воздуха.
Молярная масса кислорода (O₂) = 2 16 = 32 г/моль.
Средняя молярная масса воздуха ≈ 29 г/моль.
Поскольку 32 > 29, кислород оседает на дно сосуда, вытесняя более легкий воздух вверх и наружу. Это эффективный способ сбора газов, плотность которых выше плотности воздуха.
3. Распознавание кислорода
Что делали:
Подготовка лучинки: Берется деревянная лучинка, поджигается, а затем пламя задувается так, чтобы остался только тлеющий уголёк.
Проверка: Тлеющая лучинка осторожно опускается в сосуд, где предположительно собран кислород.
Что наблюдали:
Тлеющая лучинка ярко вспыхивает или вновь загорается пламенем.
Выводы и объяснение:
Свойство кислорода: Кислород является газом, который не горит сам, но активно поддерживает горение. Высокая концентрация кислорода в сосуде (по сравнению с воздухом) значительно ускоряет процесс горения тлеющей лучинки, заставляя её вспыхнуть. Это качественная реакция на кислород, подтверждающая его присутствие.
Вариант 2: Получение кислорода из перекиси водорода (H₂O₂)
В этом варианте кислород получают из жидкой перекиси водорода с использованием катализатора, что делает процесс более быстрым и безопасным, так как не требуется нагревание.
1. Сборка прибора и проверка его герметичности
Что делали:
Действия по сборке прибора и проверке герметичности точно такие же, как и в Варианте 1 (помещение прибора в ладонь, опускание трубки в воду, согревание пробирки).
Что наблюдали:
Появление пузырьков воздуха из конца газоотводной трубки в воде.
Выводы и объяснение:
Принцип: Принцип проверки герметичности и выводы остаются теми же. Расширение воздуха при нагревании ладонью и его выход через трубку подтверждают отсутствие утечек в системе.
2. Проведение реакции и сбор газа
Что делали:
Добавление реагентов: Пробка с газоотводной трубкой временно вынимается. В пробирку наливается 3-4 мл аптечного препарата перекиси водорода (обычно 3% раствор H₂O₂). Затем добавляется небольшое количество оксида марганца(IV) (MnO₂) на кончике шпателя.
Быстрое закрытие и сбор: Пробирка-реактор быстро закрывается пробкой с газоотводной трубкой, и конец трубки опускается в сосуд-приёмник.
Что наблюдали:
Сразу после добавления оксида марганца(IV) наблюдается очень интенсивное и бурное выделение газа – множество пузырьков.
Выводы и объяснение:
Химическая реакция: Перекись водорода (H₂O₂) самопроизвольно разлагается на воду и кислород, но этот процесс в обычных условиях протекает очень медленно.
Уравнение реакции: 2H₂O₂(ж) —(MnO₂)—> 2H₂O(ж) + O₂(г)↑
Стрелка вверх (↑) указывает на выделение газа.
Роль катализатора: Оксид марганца(IV) (MnO₂) в этой реакции выступает в роли катализатора. Катализатор – это вещество, которое увеличивает скорость химической реакции, но при этом само не расходуется и не входит в состав конечных продуктов реакции. Он остается неизменным после реакции и может быть использован повторно. В данном случае MnO₂ значительно ускоряет разложение перекиси водорода, делая его видимым и быстрым.
Метод сбора: Как и в Варианте 1, кислород собирают методом вытеснения воздуха, поскольку он тяжелее воздуха (32 г/моль против ≈29 г/моль).
3. Распознавание кислорода
Что делали:
Аналогично Варианту 1, готовится тлеющая лучинка и опускается в сосуд с собранным газом.
Что наблюдали:
Тлеющая лучинка ярко вспыхивает.
Выводы и объяснение:
Свойство кислорода: Результат подтверждает, что собранный газ – кислород, так как он активно поддерживает горение. Это свойство является ключевым для его идентификации.
Таким образом, оба варианта демонстрируют получение кислорода, его сбор методом вытеснения воздуха (благодаря его плотности) и распознавание по способности поддерживать горение. Различие заключается в исходных реагентах и условиях проведения реакции (нагревание против каталитического разложения).

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.





Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!