
Учебник «Химия» для 8-го класса, написанный Габриеляном и Остроумовым, представляет собой качественное учебное пособие, которое помогает школьникам погрузиться в мир химии и освоить ее основные понятия. Книга отличается доступным языком изложения, продуманной структурой и ярким оформлением, что делает процесс изучения увлекательным и понятным.
ГДЗ по Химии 8 Класс Практическая работа 6 Габриелян, Остроумов — Подробные Ответы
ПРИГОТОВЛЕНИЕ РАСТВОРА С ЗАДАННОЙ МАССОВОЙ ДОЛЕЙ РАСТВОРЁННОГО ВЕЩЕСТВА
В кулинарных книгах и пособиях по домашнему консервированию нередко предлагается приготовить раствор с заданной массовой долей растворённого вещества. Как это сделать?
При выполнении этой практической работы вам необходимо приготовить три раствора заданной концентрации путём растворения твёрдого вещества в воде, разбавления раствора и добавления твёрдого вещества к имеющемуся раствору. Получите у учителя вариант задания.
Приготовление раствора 1.
1. Рассчитайте массу твёрдого вещества и воды, необходимых для приготовления раствора 1. Зная, что плотность воды равна 1 г/мл, рассчитайте объём воды, необходимой для приготовления раствора.
2. Взвесьте твёрдое вещество в соответствии с рассчитанной массой и перенесите в химический стакан.
3. Мерным цилиндром отмерьте вычисленный объём воды и добавьте к веществу в химическом стакане. Перемешивая содержимое стакана стеклянной палочкой, добейтесь полного растворения вещества в воде.
4. Приготовленный раствор отдайте учителю.
Приготовление раствора 2.
Рассчитайте массу воды, которую необходимо добавить к раствору 1, чтобы получить раствор 2 меньшей концентрации. Рассчитайте объём воды. Отмерьте воду с помощью мерного цилиндра и добавьте в раствор 1. Какова масса раствора 2?
Приготовление раствора 3.
Рассчитайте массу твёрдого вещества, которое следует добавить к раствору 2, чтобы получить раствор 3 большей концентрации. На весах взвесьте необходимую массу вещества, добавьте его в раствор 2 и перемешайте стеклянной палочкой до полного растворения. Какова масса раствора 3?
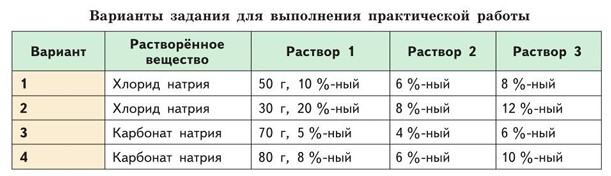
Вариант 1
Приготовление раствора 1
\( m(\text{NaCl}) = m(\text{р-ра}) \cdot \frac{\omega(\text{NaCl})}{100\%} = 50 \cdot 0,1 = 5 \text{ г} \)
\( m(H_2O) = m(\text{р-ра}) — m(\text{NaCl}) = 50 — 5 = 45 \text{ г} \)
\( V(H_2O) = 45 \text{ мл} \)
Отмерили 5 г хлорида натрия и перенесли его в химический стакан. Затем с помощью мерного цилиндра отсчитали 45 мл воды и добавили её к соли в стакане. Смесь тщательно перемешивали до полного растворения вещества.
Приготовление раствора 2
| Масса NaCl в растворе | 5 г | 6% |
|---|---|---|
| Масса раствора 2 | x г | 100% |
\( x = \frac{5 \cdot 100}{6} = 83 \text{ г} \)
\( m(H_2O) = m(\text{р-ра 2}) — m(\text{р-ра 1}) = 83 — 50 = 33 \text{ г} \)
\( V(H_2O) = 33 \text{ мл} \)
С помощью мерного цилиндра измерили 33 мл воды и добавили её к первому раствору.
Приготовление раствора 3
| Масса NaCl в растворе | (5 + y) г | 8% |
|---|---|---|
| Масса раствора 3 | (83 + y) г | 100% |
Решение уравнения:
\( 100(5 + y) = 8(83 + y) \)
\( 500 + 100y = 664 + 8y \)
\( 100y — 8y = 664 — 500 \)
\( 92y = 164 \)
\( y = \frac{164}{92} = 1,78 \text{ г} \)
Отмерили 1,78 г хлорида натрия и растворили его во втором растворе.
Масса полученного раствора:
\( 83 + 1,78 = 84,78 \text{ г} \)
Вариант 2
Приготовление раствора 1
\( m(\text{NaCl}) = m(\text{р-ра}) \cdot \frac{\omega(\text{NaCl})}{100\%} = 30 \cdot 0,2 = 6 \text{ г} \)
\( m(H_2O) = m(\text{р-ра}) — m(\text{NaCl}) = 30 — 6 = 24 \text{ г} \)
\( V(H_2O) = 24 \text{ мл} \)
Отмерили 6 г хлорида натрия и перенесли его в химический стакан. Затем с помощью мерного цилиндра отсчитали 24 мл воды и добавили её к соли в стакан. Смесь тщательно перемешивали до полного растворения вещества.
Приготовление раствора 2
| Масса NaCl в растворе | 6 г | 8% |
|---|---|---|
| Масса раствора 2 | x г | 100% |
\( x = \frac{6 \cdot 100}{8} = 75 \text{ г} \)
\( m(H_2O) = m(\text{р-ра 2}) — m(\text{р-ра 1}) = 75 — 30 = 45 \text{ г} \)
\( V(H_2O) = 45 \text{ мл} \)
С помощью мерного цилиндра измерили 45 мл воды и добавили её к первому раствору.
Приготовление раствора 3
| Масса NaCl в растворе | (6 + y) г | 12% |
|---|---|---|
| Масса раствора 3 | (75 + y) г | 100% |
Решение уравнения:
\( 100(6 + y) = 12(75 + y) \)
\( 600 + 100y = 900 + 12y \)
\( 100y — 12y = 900 — 600 \)
\( 88y = 300 \)
\( y = \frac{300}{88} = 3,41 \text{ г} \)
Отмерили 3,41 г хлорида натрия и растворили его во втором растворе.
Масса полученного раствора:
\( 75 + 3,41 = 78,41 \text{ г} \)
Вариант 3
Приготовление раствора 1
\( m(\text{Na}_2\text{CO}_3) = m(\text{р-ра}) \cdot \frac{\omega(\text{Na}_2\text{CO}_3)}{100\%} = 70 \cdot 0,05 = 3,5 \text{ г} \)
\( m(H_2O) = m(\text{р-ра}) — m(\text{Na}_2\text{CO}_3) = 70 — 3,5 = 66,5 \text{ г} \)
\( V(H_2O) = 66,5 \text{ мл} \)
Отмерили 3,5 г карбоната натрия и перенесли его в химический стакан. Затем с помощью мерного цилиндра измерили 66,5 мл воды и добавили её к карбонату натрия в стакане. Смесь тщательно перемешивали до полного растворения вещества.
Приготовление раствора 2
| Масса Na2CO3 в растворе | 3,5 г | 4% |
|---|---|---|
| Масса раствора 2 | x г | 100% |
\( x = \frac{3,5 \cdot 100}{4} = 87,5 \text{ г} \)
\( m(H_2O) = m(\text{р-ра 2}) — m(\text{р-ра 1}) = 87,5 — 70 = 17,5 \text{ г} \)
\( V(H_2O) = 17,5 \text{ мл} \)
С помощью мерного цилиндра измерили 17,5 мл воды и добавили её к первому раствору.
Приготовление раствора 3
| Масса NaCl в растворе | (3,5 + y) г | 6% |
|---|---|---|
| Масса раствора 3 | (87,5 + y) г | 100% |
Решение уравнения:
\( 100(3,5 + y) = 6(87,5 + y) \)
\( 350 + 100y = 525 + 6y \)
\( 100y — 6y = 525 — 350 \)
\( 94y = 175 \)
\( y = \frac{175}{94} = 1,86 \text{ г} \)
Отмерили 1,86 г карбоната натрия и растворили его во втором растворе.
Масса полученного раствора:
\( 87,5 + 1,86 = 89,36 \text{ г} \)
Вариант 4
Приготовление раствора 1
\( m(\text{Na}_2\text{CO}_3) = m(\text{р-ра}) \cdot \frac{\omega(\text{Na}_2\text{CO}_3)}{100\%} = 80 \cdot 0,08 = 6,4 \text{ г} \)
\( m(H_2O) = m(\text{р-ра}) — m(\text{Na}_2\text{CO}_3) = 80 — 6,4 = 73,6 \text{ г} \)
\( V(H_2O) = 73,6 \text{ мл} \)
Отмерили 6,4 г карбоната натрия и перенесли его в химический стакан. Затем с помощью мерного цилиндра измерили 73,6 мл воды и добавили её к карбонату натрия в стакане. Смесь тщательно перемешивали до полного растворения вещества.
Приготовление раствора 2
| Масса Na2CO3 в растворе | 6,4 г | 6% |
|---|---|---|
| Масса раствора 2 | x г | 100% |
\( x = \frac{6,4 \cdot 100}{6} = 106,7 \text{ г} \)
\( m(H_2O) = m(\text{р-ра 2}) — m(\text{р-ра 1}) = 106,7 — 80 = 26,7 \text{ г} \)
\( V(H_2O) = 26,7 \text{ мл} \)
С помощью мерного цилиндра измерили 26,7 мл воды и добавили её к первому раствору.
Приготовление раствора 3
| Масса NaCl в растворе | (6,4 + y) г | 10% |
|---|---|---|
| Масса раствора 3 | (106,7 + y) г | 100% |
Решение уравнения:
\( 100(6,4 + y) = 10(106,7 + y) \)
\( 640 + 100y = 1067 + 10y \)
\( 100y — 10y = 1067 — 640 \)
\( 90y = 427 \)
\( y = \frac{427}{90} = 4,74 \text{ г} \)
Отмерили 4,74 г карбоната натрия и растворили его во втором растворе.
Масса полученного раствора:
\( 106,7 + 4,74 = 111,44 \text{ г} \)
Вариант 1
Растворённое вещество: Хлорид натрия (NaCl)
Раствор 1: 50 г, 10%-ный
Раствор 2: 6%-ный
Раствор 3: 8%-ный
1. Приготовление раствора 1
Цель: Приготовить 50 г 10%-ного раствора хлорида натрия.
Расчёт массы твёрдого вещества (NaCl):
Масса растворённого вещества \( m(\text{NaCl}) \) определяется как произведение общей массы раствора \( m(\text{р-ра}) \) на массовую долю растворённого вещества \( \omega(\text{NaCl}) \), выраженную в долях единицы.
\( m(\text{NaCl}) = m(\text{р-ра}) \cdot \frac{\omega(\text{NaCl})}{100\%} = 50 \text{ г} \cdot \frac{10\%}{100\%} = 50 \cdot 0,1 = 5 \text{ г} \)
Расчёт массы воды (H₂O):
Масса воды \( m(\text{H}_2\text{O}) \) — это разница между общей массой раствора и массой растворённого вещества.
\( m(\text{H}_2\text{O}) = m(\text{р-ра}) — m(\text{NaCl}) = 50 \text{ г} — 5 \text{ г} = 45 \text{ г} \)
Расчёт объёма воды (H₂O):
Поскольку плотность воды равна 1 г/мл, объём воды \( V(\text{H}_2\text{O}) \) численно равен её массе.
\( V(\text{H}_2\text{O}) = 45 \text{ мл} \)
Практические шаги:
1. Взвесили 5 г NaCl на весах и переместили в химический стакан.
2. Мерным цилиндром отмерили 45 мл воды и добавили к NaCl в химическом стакане.
3. Перемешивали содержимое стакана стеклянной палочкой до полного растворения вещества в воде.
4. Приготовленный раствор 1 готов.
2. Приготовление раствора 2
Цель: Получить раствор 2 с меньшей концентрацией (6%) путём добавления воды к раствору 1.
Принцип: При разбавлении раствора масса растворённого вещества остаётся неизменной. Масса NaCl в растворе 1 составляет 5 г. Эта же масса NaCl будет содержаться в растворе 2.
Расчёт общей массы раствора 2:
| Масса NaCl в растворе | 5 г | 6% |
|---|---|---|
| Масса раствора 2 | x г | 100% |
Из пропорции: \( \frac{5}{x} = \frac{6}{100} \)
\( x = \frac{5 \cdot 100}{6} \approx 83,33 \text{ г} \) (округляем до 83 г, как в примере решения)
Это общая масса раствора 2.
Расчёт массы добавленной воды:
\( m(\text{H}_2\text{O})_{\text{добавленной}} = m(\text{р-ра 2}) — m(\text{р-ра 1}) = 83 \text{ г} — 50 \text{ г} = 33 \text{ г} \)
Расчёт объёма добавленной воды:
\( V(\text{H}_2\text{O})_{\text{добавленной}} = 33 \text{ мл} \)
Практические шаги:
1. Мерным цилиндром отмерили 33 мл воды.
2. Добавили воду к раствору 1 и перемешали.
3. Масса полученного раствора 2 составляет 83 г.
3. Приготовление раствора 3
Цель: Получить раствор 3 с большей концентрацией (8%) путём добавления твёрдого вещества (NaCl) к раствору 2.
Принцип: При добавлении твёрдого вещества увеличивается как масса растворённого вещества, так и общая масса раствора. Масса воды в растворе остаётся неизменной.
Расчёт массы добавленного NaCl:
Пусть \( y \) — это масса NaCl, которую необходимо добавить.
Изначально в растворе 2 содержится 5 г NaCl. После добавления \( y \) г NaCl, общая масса растворённого вещества в растворе 3 составит \( (5 + y) \text{ г} \).
Общая масса раствора 2 составляет 83 г. После добавления \( y \) г NaCl, общая масса раствора 3 составит \( (83 + y) \text{ г} \).
Массовая доля NaCl в растворе 3 должна быть 8%.
| Масса NaCl в растворе | (5 + y) г | 8% |
|---|---|---|
| Масса раствора 3 | (83 + y) г | 100% |
Составим уравнение, используя пропорцию:
\( \frac{5 + y}{83 + y} = \frac{8}{100} \)
\( 100(5 + y) = 8(83 + y) \)
Раскроем скобки:
\( 500 + 100y = 664 + 8y \)
Перенесём члены с \( y \) в одну сторону, а числовые значения в другую:
\( 100y — 8y = 664 — 500 \)
\( 92y = 164 \)
Найдём значение \( y \):
\( y = \frac{164}{92} \approx 1,78 \text{ г} \)
Практические шаги:
1. Взвесили 1,78 г NaCl на весах.
2. Добавили NaCl к раствору 2 и перемешали стеклянной палочкой до полного растворения.
3. Масса полученного раствора 3: \( 83 \text{ г (раствор 2)} + 1,78 \text{ г (добавленный NaCl)} = 84,78 \text{ г} \)
Вариант 2
Растворённое вещество: Хлорид натрия (NaCl)
Раствор 1: 30 г, 20%-ный
Раствор 2: 8%-ный
Раствор 3: 12%-ный
1. Приготовление раствора 1
Цель: Приготовить 30 г 20%-ного раствора хлорида натрия.
Расчёт массы твёрдого вещества (NaCl):
\( m(\text{NaCl}) = 30 \text{ г} \cdot \frac{20\%}{100\%} = 30 \cdot 0,2 = 6 \text{ г} \)
Расчёт массы воды (H₂O):
\( m(\text{H}_2\text{O}) = 30 \text{ г} — 6 \text{ г} = 24 \text{ г} \)
Расчёт объёма воды (H₂O):
\( V(\text{H}_2\text{O}) = 24 \text{ мл} \)
Практические шаги:
1. Взвесили 6 г NaCl на весах и переместили в химический стакан.
2. Мерным цилиндром отмерили 24 мл воды и добавили к NaCl в химическом стакане.
3. Перемешивали содержимое стакана стеклянной палочкой до полного растворения вещества в воде.
4. Приготовленный раствор 1 готов.
2. Приготовление раствора 2
Цель: Получить раствор 2 с меньшей концентрацией (8%) путём добавления воды к раствору 1.
Принцип: Масса растворённого вещества (6 г NaCl) остаётся неизменной.
Расчёт общей массы раствора 2:
| Масса NaCl в растворе | 6 г | 8% |
|---|---|---|
| Масса раствора 2 | x г | 100% |
Из пропорции: \( \frac{6}{x} = \frac{8}{100} \)
\( x = \frac{6 \cdot 100}{8} = 75 \text{ г} \)
Это общая масса раствора 2.
Расчёт массы добавленной воды:
\( m(\text{H}_2\text{O})_{\text{добавленной}} = m(\text{р-ра 2}) — m(\text{р-ра 1}) = 75 \text{ г} — 30 \text{ г} = 45 \text{ г} \)
Расчёт объёма добавленной воды:
\( V(\text{H}_2\text{O})_{\text{добавленной}} = 45 \text{ мл} \)
Практические шаги:
1. Мерным цилиндром отмерили 45 мл воды.
2. Добавили воду к раствору 1 и перемешали.
3. Масса полученного раствора 2 составляет 75 г.
3. Приготовление раствора 3
Цель: Получить раствор 3 с большей концентрацией (12%) путём добавления твёрдого вещества (NaCl) к раствору 2.
Принцип: Увеличивается как масса растворённого вещества, так и общая масса раствора.
Расчёт массы добавленного NaCl:
Пусть \( y \) — это масса NaCl, которую необходимо добавить.
Масса NaCl в растворе 3 составит \( (6 + y) \text{ г} \).
Масса раствора 3 составит \( (75 + y) \text{ г} \).
Массовая доля NaCl в растворе 3 должна быть 12%.
| Масса NaCl в растворе | (6 + y) г | 12% |
|---|---|---|
| Масса раствора 3 | (75 + y) г | 100% |
Составим уравнение:
\( \frac{6 + y}{75 + y} = \frac{12}{100} \)
\( 100(6 + y) = 12(75 + y) \)
Раскроем скобки:
\( 600 + 100y = 900 + 12y \)
Перенесём члены:
\( 100y — 12y = 900 — 600 \)
\( 88y = 300 \)
Найдём значение \( y \):
\( y = \frac{300}{88} \approx 3,41 \text{ г} \)
Практические шаги:
1. Взвесили 3,41 г NaCl на весах.
2. Добавили NaCl к раствору 2 и перемешали стеклянной палочкой до полного растворения.
3. Масса полученного раствора 3: \( 75 \text{ г (раствор 2)} + 3,41 \text{ г (добавленный NaCl)} = 78,41 \text{ г} \)
Вариант 3
Растворённое вещество: Карбонат натрия (Na₂CO₃)
Раствор 1: 70 г, 5%-ный
Раствор 2: 4%-ный
Раствор 3: 6%-ный
1. Приготовление раствора 1
Цель: Приготовить 70 г 5%-ного раствора карбоната натрия.
Расчёт массы твёрдого вещества (Na₂CO₃):
\( m(\text{Na}_2\text{CO}_3) = 70 \text{ г} \cdot \frac{5\%}{100\%} = 70 \cdot 0,05 = 3,5 \text{ г} \)
Расчёт массы воды (H₂O):
\( m(\text{H}_2\text{O}) = 70 \text{ г} — 3,5 \text{ г} = 66,5 \text{ г} \)
Расчёт объёма воды (H₂O):
\( V(\text{H}_2\text{O}) = 66,5 \text{ мл} \)
Практические шаги:
1. Взвесили 3,5 г \( \text{Na}_2\text{CO}_3 \) на весах и переместили в химический стакан.
2. Мерным цилиндром отмерили 66,5 мл воды и добавили к \( \text{Na}_2\text{CO}_3 \) в химическом стакане.
3. Перемешивали содержимое стакана стеклянной палочкой до полного растворения вещества в воде.
4. Приготовленный раствор 1 готов.
2. Приготовление раствора 2
Цель: Получить раствор 2 с меньшей концентрацией (4%) путём добавления воды к раствору 1.
Принцип: Масса растворённого вещества (3,5 г Na₂CO₃) остаётся неизменной.
Расчёт общей массы раствора 2:
| Масса Na2CO3 в растворе | 3,5 г | 4% |
|---|---|---|
| Масса раствора 2 | x г | 100% |
Из пропорции: \( \frac{3,5}{x} = \frac{4}{100} \)
\( x = \frac{3,5 \cdot 100}{4} = 87,5 \text{ г} \)
Это общая масса раствора 2.
Расчёт массы добавленной воды:
\( m(\text{H}_2\text{O})_{\text{добавленной}} = m(\text{р-ра 2}) — m(\text{р-ра 1}) = 87,5 \text{ г} — 70 \text{ г} = 17,5 \text{ г} \)
Расчёт объёма добавленной воды:
\( V(\text{H}_2\text{O})_{\text{добавленной}} = 17,5 \text{ мл} \)
Практические шаги:
1. Мерным цилиндром отмерили 17,5 мл воды.
2. Добавили воду к раствору 1 и перемешали.
3. Масса полученного раствора 2 составляет 87,5 г.
3. Приготовление раствора 3
Цель: Получить раствор 3 с большей концентрацией (6%) путём добавления твёрдого вещества (Na₂CO₃) к раствору 2.
Принцип: Увеличивается как масса растворённого вещества, так и общая масса раствора.
Расчёт массы добавленного Na₂CO₃:
Пусть \( y \) — это масса Na₂CO₃, которую необходимо добавить.
Масса Na₂CO₃ в растворе 3 составит \( (3,5 + y) \text{ г} \).
Масса раствора 3 составит \( (87,5 + y) \text{ г} \).
Массовая доля Na₂CO₃ в растворе 3 должна быть 6%.
| Масса Na2CO3 в растворе | (3,5 + y) г | 6% |
|---|---|---|
| Масса раствора 3 | (87,5 + y) г | 100% |
Составим уравнение:
\( \frac{3,5 + y}{87,5 + y} = \frac{6}{100} \)
\( 100(3,5 + y) = 6(87,5 + y) \)
Раскроем скобки:
\( 350 + 100y = 525 + 6y \)
Перенесём члены:
\( 100y — 6y = 525 — 350 \)
\( 94y = 175 \)
Найдём значение \( y \):
\( y = \frac{175}{94} \approx 1,86 \text{ г} \)
Практические шаги:
1. Взвесили 1,86 г \( \text{Na}_2\text{CO}_3 \) на весах.
2. Добавили \( \text{Na}_2\text{CO}_3 \) к раствору 2 и перемешали стеклянной палочкой до полного растворения.
3. Масса полученного раствора 3: \( 87,5 \text{ г (раствор 2)} + 1,86 \text{ г (добавленный Na}_2\text{CO}_3) = 89,36 \text{ г} \)
Вариант 4
Растворённое вещество: Карбонат натрия (Na₂CO₃)
Раствор 1: 80 г, 8%-ный
Раствор 2: 6%-ный
Раствор 3: 10%-ный
1. Приготовление раствора 1
Цель: Приготовить 80 г 8%-ного раствора карбоната натрия.
Расчёт массы твёрдого вещества (Na₂CO₃):
\( m(\text{Na}_2\text{CO}_3) = 80 \text{ г} \cdot \frac{8\%}{100\%} = 80 \cdot 0,08 = 6,4 \text{ г} \)
Расчёт массы воды (H₂O):
\( m(\text{H}_2\text{O}) = 80 \text{ г} — 6,4 \text{ г} = 73,6 \text{ г} \)
Расчёт объёма воды (H₂O):
\( V(\text{H}_2\text{O}) = 73,6 \text{ мл} \)
Практические шаги:
1. Взвесили 6,4 г \( \text{Na}_2\text{CO}_3 \) на весах и переместили в химический стакан.
2. Мерным цилиндром отмерили 73,6 мл воды и добавили к \( \text{Na}_2\text{CO}_3 \) в химическом стакане.
3. Перемешивали содержимое стакана стеклянной палочкой до полного растворения вещества в воде.
4. Приготовленный раствор 1 готов.
2. Приготовление раствора 2
Цель: Получить раствор 2 с меньшей концентрацией (6%) путём добавления воды к раствору 1.
Принцип: Масса растворённого вещества (6,4 г Na₂CO₃) остаётся неизменной.
Расчёт общей массы раствора 2:
| Масса Na2CO3 в растворе | 6,4 г | 6% |
|---|---|---|
| Масса раствора 2 | x г | 100% |
Из пропорции: \( \frac{6,4}{x} = \frac{6}{100} \)
\( x = \frac{6,4 \cdot 100}{6} \approx 106,7 \text{ г} \)
Это общая масса раствора 2.
Расчёт массы добавленной воды:
\( m(\text{H}_2\text{O})_{\text{добавленной}} = m(\text{р-ра 2}) — m(\text{р-ра 1}) = 106,7 \text{ г} — 80 \text{ г} = 26,7 \text{ г} \)
Расчёт объёма добавленной воды:
\( V(\text{H}_2\text{O})_{\text{добавленной}} = 26,7 \text{ мл} \)
Практические шаги:
1. Мерным цилиндром отмерили 26,7 мл воды.
2. Добавили воду к раствору 1 и перемешали.
3. Масса полученного раствора 2 составляет 106,7 г.
3. Приготовление раствора 3
Цель: Получить раствор 3 с большей концентрацией (10%) путём добавления твёрдого вещества (Na₂CO₃) к раствору 2.
Принцип: Увеличивается как масса растворённого вещества, так и общая масса раствора.
Расчёт массы добавленного Na₂CO₃:
Пусть \( y \) — это масса Na₂CO₃, которую необходимо добавить.
Масса Na₂CO₃ в растворе 3 составит \( (6,4 + y) \text{ г} \).
Масса раствора 3 составит \( (106,7 + y) \text{ г} \).
Массовая доля Na₂CO₃ в растворе 3 должна быть 10%.
| Масса Na2CO3 в растворе | (6,4 + y) г | 10% |
|---|---|---|
| Масса раствора 3 | (106,7 + y) г | 100% |
Составим уравнение:
\( \frac{6,4 + y}{106,7 + y} = \frac{10}{100} \)
\( 100(6,4 + y) = 10(106,7 + y) \)
Раскроем скобки:
\( 640 + 100y = 1067 + 10y \)
Перенесём члены:
\( 100y — 10y = 1067 — 640 \)
\( 90y = 427 \)
Найдём значение \( y \):
\( y = \frac{427}{90} \approx 4,74 \text{ г} \)
Практические шаги:
1. Взвесили 4,74 г \( \text{Na}_2\text{CO}_3 \) на весах.
2. Добавили \( \text{Na}_2\text{CO}_3 \) к раствору 2 и перемешали стеклянной палочкой до полного растворения.
3. Масса полученного раствора 3: \( 106,7 \text{ г (раствор 2)} + 4,74 \text{ г (добавленный Na}_2\text{CO}_3) = 111,44 \text{ г} \)

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.





Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!