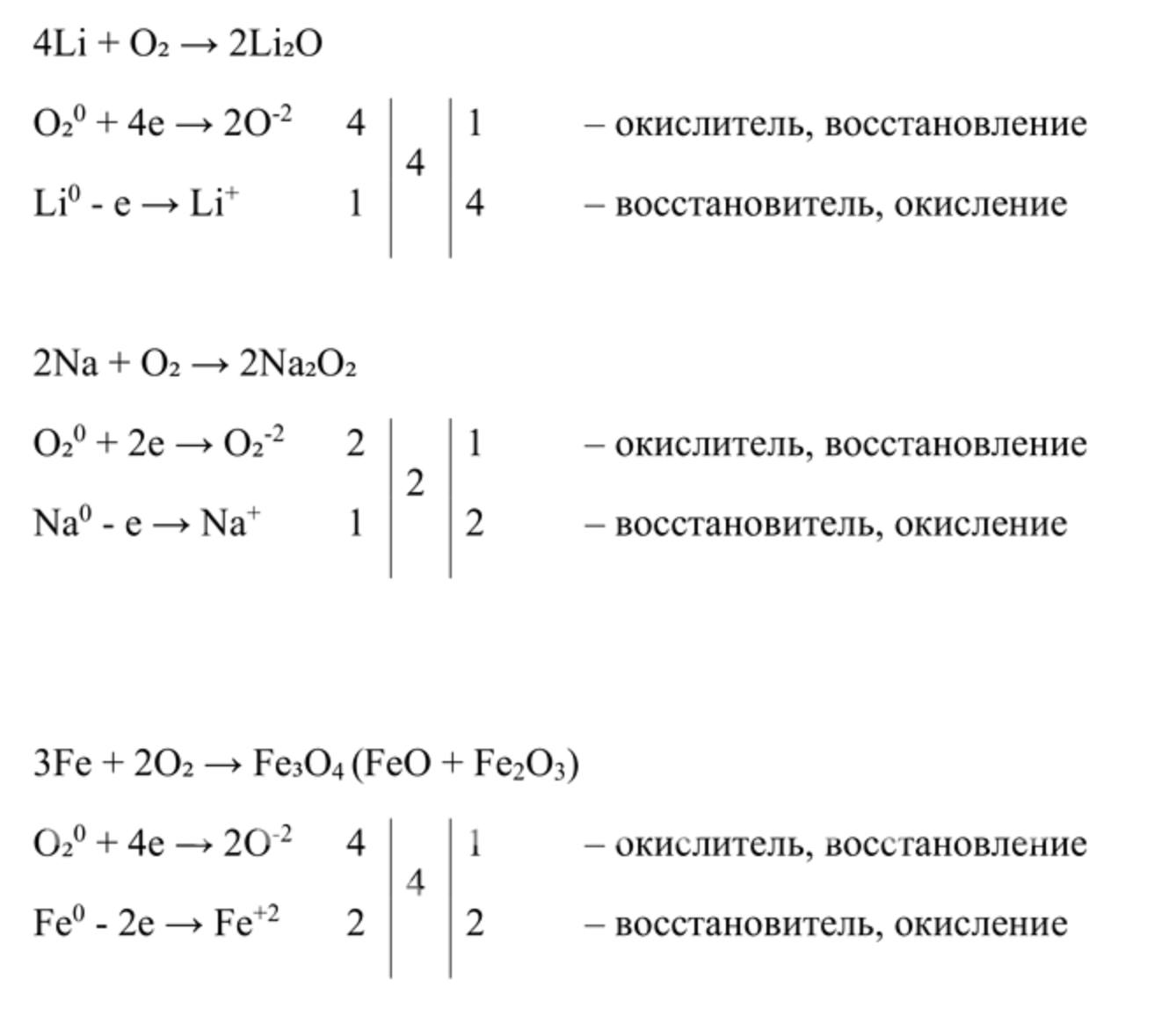Учебник «Химия. 9 класс» — это широко востребованное пособие для изучения основ химии. Он отличается простым и понятным языком, логичной организацией материала и яркими иллюстрациями, что делает процесс обучения увлекательным и доступным.
Преимущества учебника:
- Понятное изложение — сложные темы объясняются простым языком с примерами из повседневной жизни.
- Логичная структура — материал представляется постепенно, от простых концепций к более сложным.
- Наглядность — схемы, таблицы и иллюстрации способствуют лучшему усвоению информации.
ГДЗ по Химии 9 Класс Глава 23 Дополнительное задание 4 Рабочая Тетрадь Габриелян, Остроумов — Подробные Ответы
Запишите соответствующие уравнения реакций, рассмотрите окислительно-восстановительные процессы.
Рассмотрим несколько примеров окислительно-восстановительных реакций:
1. Реакция между железом и кислородом:
4Fe + 3O2 → 2Fe2O3
В этой реакции железо (Fe) окисляется до Fe2O3, теряя электроны, а кислород (O2) восстанавливается, принимая электроны.
2. Реакция между медью(II) оксидом и водородом:
CuO + H2 → Cu + H2O
В этой реакции медь(II) оксид (CuO) восстанавливается до меди (Cu), а водород (H2) окисляется до воды (H2O).
3. Реакция между марганцем и перманганатом калия в кислой среде:
MnO4— + 8H+ + 5e— → Mn2+ + 4H2O
В этой реакции перманганат (MnO4—) восстанавливается до Mn2+, а электроны (e—) отдаются.
4. Реакция между натрием и хлором:
2Na + Cl2 → 2NaCl
В этой реакции натрий (Na) окисляется до NaCl, теряя электроны, а хлор (Cl2) восстанавливается, принимая электроны.
Каждая из этих реакций демонстрирует окислительно-восстановительные процессы, где один элемент теряет электроны (окисляется), а другой принимает электроны (восстанавливается).
Окислительно-восстановительные реакции (редокс-реакции) — это химические реакции, в которых происходит передача электронов между реагентами. В таких реакциях один элемент окисляется (теряет электроны), а другой восстанавливается (принимает электроны).
1. Реакция между железом и кислородом:
Уравнение реакции:
4Fe + 3O2 → 2Fe2O3
В этой реакции железо (Fe) окисляется до оксида железа (III) — Fe2O3, теряя электроны. Кислород (O2) восстанавливается, принимая электроны. Процесс можно представить следующим образом:
- Окисление: Fe → Fe3+ + 3e—
- Восстановление: O2 + 4e— + 2H+ → 2H2O
2. Реакция между медью(II) оксидом и водородом:
Уравнение реакции:
CuO + H2 → Cu + H2O
В этой реакции медь(II) оксид (CuO) восстанавливается до меди (Cu), а водород (H2) окисляется до воды (H2O). Процесс можно представить так:
- Окисление: H2 → 2H+ + 2e—
- Восстановление: CuO + 2e— → Cu + O2-
3. Реакция между марганцем и перманганатом калия в кислой среде:
Уравнение реакции:
MnO4— + 8H+ + 5e— → Mn2+ + 4H2O
В этой реакции перманганат калия (MnO4—) восстанавливается до иона марганца (Mn2+). Восстановление происходит с помощью передачи электронов от восстановителя. Окисление может происходить в другом полуреакции, например, с участием какого-либо металла или другого восстановителя.
Заключение:
Окислительно-восстановительные реакции играют важную роль в химии и биохимии. Понимание этих процессов позволяет объяснить многие явления, включая коррозию, горение и метаболизм в живых организмах.
Лабораторные работы