
Учебник «Химия. 9 класс» О. С. Габриеляна — популярное пособие для изучения основ химии. Он выделяется доступным языком, логичной структурой и ярким иллюстративным материалом, что делает обучение понятным и интересным.
Преимущества учебника:
- Доступность изложения — сложные темы объясняются простым языком с примерами из жизни.
- Продуманная структура — материал подаётся постепенно, от простого к сложному.
- Наглядность — схемы, таблицы и рисунки помогают лучше усвоить информацию.
Этот учебник идеально подходит для первых шагов в мире химии!
ГДЗ по Химии 9 Класс Параграф 21 Практическая работа 5 Габриелян, Остроумов — Подробные Ответы
1. В две пробирки налейте по 20 капель дистиллированной воды и добавьте но 3—4 капли раствора фиолетового лакмуса. В третью пробирку внесите примерно 20 капель раствора известковой воды. Установите пробирки в гптатив. Туда же поместите и три пустые пробирки.
2. В прибор для получения газов внесите 2—3 небольших кусочка мрамора и закрепите прибор в лапке штатива. В воронку налейте немного соляной кислоты, чтобы она покрывала кусочки мрамора. Газоотводную трубку прибора опустите в пробирку с водой, подкрашенной раствором лакмуса. Что наблюдаете? Запишите уравнения реакции в молекулярной и ионной формах.
3. Пропускайте выделяющийся оксид углерода(4) через воду до тех пор, пока раствор лакмуса не приобретёт красную окраску. Объясните наблюдаемое и запишите уравнения реакции в молекулярной и ионной формах.
Сравните окраску раствора с окраской раствора в контрольной пробирке.
4. Промойте конец газоотводной трубки в стакане с водой. После этого конец газоотводной трубки перенесите в пробирку с известковой водой и пропускайте газ до помутнения раствора (рис. 49).
5. Продолжайте пропускать газ через помутневший раствор. Что наблюдаете? Запишите уравнения реакции в молекулярной и ионной формах.
Примечание. Если скорость выделения газа замедлилась, то в пробирку с мрамором можно добавить немного соляной кислоты.
6. Промойте конец газоотводной трубки в стакане с водой. Перенесите газоотводную трубку в четвёртую пробирку, опустив её до дна пробирки. Соберите газ методом вытеснения воздуха (почему именно этим методом?).
7. Зажгите лучинку и внесите её в пробирку. Что наблюдаете? Объясните наблюдаемое.
8. В одну чистую пробирку налейте 2 мл раствора карбоната натрия, в другую — 2 мл раствора карбоната калия. Добавьте в каждую пробирку 1— 2 мл раствора серной кислоты. Что наблюдаете? Запишите уравнения реакций в молекулярной и ионной формах.
Разберите установку и приведите в порядок рабочее место.
Оформите отчёт.
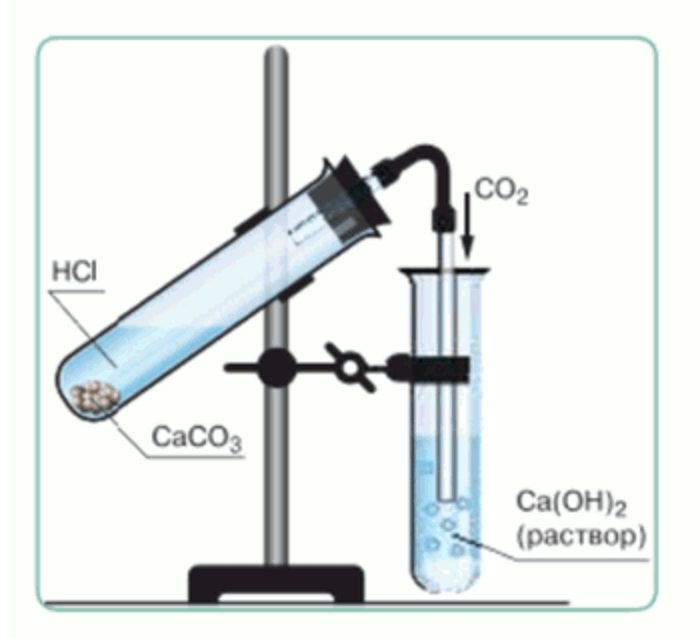
В две пробирки налейте по 20 капель дистиллированной воды и добавьте по 3—4 капли раствора фиолетового лакмуса. В третью пробирку внесите примерно 20 капель раствора известковой воды. Установите пробирки в штатив. Туда же поместите и три пустые пробирки.
2. В прибор для получения газов внесите 2—3 небольших кусочка мрамора и закрепите прибор в лапке штатива. В воронку налейте немного соляной кислоты, чтобы она покрывала кусочки мрамора. Газоотводную трубку прибора опустите в пробирку с водой, подкрашенной раствором лакмуса. Что наблюдаете?
При взаимодействии соляной кислоты с мрамором выделяется углекислый газ, что приводит к изменению цвета лакмусовой жидкости на красный.
Уравнения реакции:
Молекулярная форма: CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Ионная форма: CaCO3 + 2H+ → Ca2+ + CO2 + H2O
3. Пропускайте выделяющийся оксид углерода(IV) через воду до тех пор, пока раствор лакмуса не приобретёт красную окраску. Объясните наблюдаемое и запишите уравнения реакции в молекулярной и ионной формах.
При растворении углекислого газа в воде образуется угольная кислота, которая диссоциирует, увеличивая концентрацию ионов водорода (H+) и меняя цвет лакмуса на красный.
Уравнения реакции:
Молекулярная форма: CO2 + H2O ⇌ H<2>CO3
Ионная форма: CO2 + H2O ⇌ H+ + HCO3—
4. Промойте конец газоотводной трубки в стакане с водой. После этого конец газоотводной трубки перенесите в пробирку с известковой водой и пропускайте газ до помутнения раствора.
5. Продолжайте пропускать газ через помутневший раствор. Что наблюдаете?
Раствор известковой воды мутнеет из-за образования карбоната кальция (CaCO3) при взаимодействии с углекислым газом.
Уравнения реакции:
Молекулярная форма: Ca(OH)2 + CO2 → CaCO3(осадок) + H2O
Ионная форма: Ca2+ + 2OH— + CO2 → CaCO3(осадок) + H2O
6. Промойте конец газоотводной трубки в стакане с водой. Перенесите газоотводную трубку в четвёртую пробирку, опустив её до дна пробирки. Соберите газ методом вытеснения воздуха (почему именно этим методом?).
Метод вытеснения воздуха используется, так как углекислый газ тяжелее воздуха и может быть собран в перевёрнутой пробирке.
7. Зажгите лучинку и внесите её в пробирку. Что наблюдаете? Объясните наблюдаемое.
При внесении горящей лучинки в пробирку с углекислым газом она гаснет, так как углекислый газ не поддерживает горение.
8. В одну чистую пробирку налейте 2 мл раствора карбоната натрия, в другую — 2 мл раствора карбоната калия. Добавьте в каждую пробирку 1—2 мл раствора серной кислоты. Что наблюдаете?
В обеих пробирках происходит выделение углекислого газа, что проявляется в образовании пузырьков.
Уравнения реакций:
(для карбоната натрия)
Молекулярная форма: Na2CO3 + H2S04 → Na2S04 + CO2 + H2O
(для карбоната калия)
Молекулярная форма: K2CO3 + H2S04 → K2S04
Цель эксперимента: Изучить процесс получения углекислого газа и провести качественную реакцию на карбонат-ион.
Оборудование и реактивы:
- Пробирки (5 штук)
- Дистиллированная вода
- Фиолетовый лакмус
- Известковая вода (раствор гидроксида кальция)
- Мрамор (карбонат кальция)
- Соляная кислота (HCl)
- Прибор для получения газов
- Штатив
- Газоотводная трубка
- Воронка
Ход работы:
- В две пробирки налейте по 20 капель дистиллированной воды. В каждую из этих пробирок добавьте по 3—4 капли раствора фиолетового лакмуса. В третью пробирку внесите примерно 20 капель раствора известковой воды. Установите пробирки в штатив. Поместите три пустые пробирки рядом.
- В прибор для получения газов внесите 2—3 небольших кусочка мрамора. Закрепите прибор в лапке штатива. В воронку налейте немного соляной кислоты, чтобы она покрывала кусочки мрамора. Газоотводную трубку прибора опустите в пробирку с водой, подкрашенной раствором лакмуса.Наблюдение: При взаимодействии соляной кислоты с мрамором выделяется углекислый газ, что приводит к изменению цвета лакмусовой жидкости.
Уравнения реакции:
Молекулярная форма:
CaCO3 + 2 HCl → CaCl2 + CO2 + H2O
Ионная форма:
CO32- + 2 H+ → CO2 + H2O
- Пропускайте выделяющийся углекислый газ через воду, пока раствор лакмуса не приобретёт красную окраску.Объяснение наблюдаемого: Углекислый газ растворяется в воде и образует угольную кислоту, которая диссоциирует, вызывая увеличение концентрации ионов водорода (H+) и изменение цвета лакмуса на красный.
Уравнения реакции:
Молекулярная форма:
CO2 + H2O ⇌ H<2CO3
Ионная форма:
CO2 + H2O ⇌ HCO3— + H+
Сравнение окраски раствора:
Раствор с лакмусом в пробирке с известковой водой останется синим, так как известковая вода является щелочной. В то время как раствор с лакмусом, в который попал углекислый газ, станет красным из-за повышения кислотности.
Лабораторые опыты



