
Учебник «Химия» для 8-го класса, написанный Габриеляном и Остроумовым, представляет собой качественное учебное пособие, которое помогает школьникам погрузиться в мир химии и освоить ее основные понятия. Книга отличается доступным языком изложения, продуманной структурой и ярким оформлением, что делает процесс изучения увлекательным и понятным.
ГДЗ по Химии 8 Класс Параграф 23 Вопрос 5 Габриелян, Остроумов — Подробные Ответы
Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) Ca → CaO → Ca(OH)₂ → CaCl₂
б) Cu → CuO → 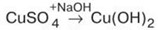
в) фосфор → оксид фосфора(V) → фосфорная кислота → фосфат калия
г) кремний → оксид кремния(IV) → силикат натрия 
а) 2Ca+O₂ = 2CaO
CaO+ H₂O = Ca(OH)₂
Ca(OH)₂+2HCl = CaCl₂+2H₂O
б) 2Cu+O₂ = 2CuO
CuO+ H₂SO₄ = CuSO₄+ H₂O
CuSO₄+2NaOH = Na₂SO₄+ Cu(OH)₂↓
Cu(OH)₂ = CuO + H₂O
CuO + H₂ = Cu + H₂O
в) 4P+5O₂ = 2P₂O₅
P₂O₅+ 3H₂O = 2H₃PO₄
H₃PO₄+ 3KOH = K₃PO₄+ 3H₂O
г) Si+O₂ = SiO₂
SiO₂+Na₂O = Na₂SiO₃
Na₂SiO₃+ H₂SO₄ = Na₂SO₄+ H₂SiO₃↓
H₂SiO₃ = SiO₂ + H₂O
а) Ca → CaO → Ca(OH)₂ → CaCl₂
Это цепочка превращений, демонстрирующая химические свойства кальция, его оксида и гидроксида.
1. Ca → CaO
Уравнение реакции: 2Ca (тв) + O₂ (г) = 2CaO (тв)
Тип реакции: Реакция соединения (синтеза), окислительно-восстановительная реакция (ОВР).
Электронные переходы и степени окисления: Исходный кальций (Ca) находится в нулевой степени окисления (Ca⁰), а кислород (O₂) также в нулевой (O⁰). В результате реакции кальций отдает два электрона, переходя в степень окисления +2 (Ca²⁺), то есть окисляется. Каждый атом кислорода принимает по два электрона, переходя в степень окисления -2 (O²⁻), то есть восстанавливается.
Тип связи: Образующийся оксид кальция (CaO) является ионным соединением, где ионы Ca²⁺ и O²⁻ удерживаются сильными электростатическими силами в кристаллической решетке.
Термодинамика и кинетика: Реакция сильно экзотермическая (ΔH < 0), то есть сопровождается значительным выделением тепла. Это обусловлено высокой активностью кальция и образованием прочной ионной решетки. При комнатной температуре реакция идет медленно (поверхность кальция пассивируется оксидной пленкой), но при нагревании или в мелкодисперсном состоянии кальций горит ярким пламенем.
Практическое значение: Эта реакция является способом получения негашеной извести (оксида кальция), которая широко используется в строительстве, металлургии и химической промышленности.
2. CaO → Ca(OH)₂
Уравнение реакции: CaO (тв) + H₂O (ж) = Ca(OH)₂ (тв/суспензия)
Тип реакции: Реакция соединения (синтеза).
Механизм реакции: Оксид кальция (CaO) является основным оксидом. Его ионная кристаллическая решетка взаимодействует с полярными молекулами воды. Ионы Ca²⁺ притягивают отрицательные полюса молекул воды, а ионы O²⁻ — положительные. Это приводит к разрыву связей в CaO и образованию гидроксид-ионов (OH⁻) из оксид-ионов и воды. Ионы Ca²⁺ и OH⁻ затем объединяются, образуя гидроксид кальция Ca(OH)₂.
Термодинамика: Реакция «гашения извести» очень сильно экзотермическая. Выделяющегося тепла достаточно для доведения воды до кипения и образования пара. Это связано с формированием прочных связей в Ca(OH)₂ и гидратацией ионов.
Растворимость и наблюдения: Гидроксид кальция малорастворим в воде. Поэтому при добавлении воды к негашеной извести образуется белая мутная суспензия, известная как «известковое молоко». Насыщенный прозрачный раствор Ca(OH)₂ называется «известковой водой».
Практическое значение: Гашеная известь используется в строительстве (как компонент растворов), для нейтрализации кислых почв в сельском хозяйстве, в водоподготовке.
3. Ca(OH)₂ → CaCl₂
Уравнение реакции: Ca(OH)₂ (водн/сусп) + 2HCl (водн) = CaCl₂ (водн) + 2H₂O (ж)
Полное ионное уравнение: Ca²⁺(водн) + 2OH⁻(водн) + 2H⁺(водн) + 2Cl⁻(водн) = Ca²⁺(водн) + 2Cl⁻(водн) + 2H₂O (ж)
Сокращенное ионное уравнение: OH⁻(водн) + H⁺(водн) = H₂O (ж)
Тип реакции: Реакция обмена (нейтрализации), кислотно-основная реакция.
Принцип нейтрализации: Гидроксид кальция (Ca(OH)₂) является основанием, а соляная кислота (HCl) — сильной кислотой. В реакции нейтрализации происходит взаимодействие ионов водорода (H⁺) из кислоты и гидроксид-ионов (OH⁻) из основания с образованием молекул воды. Это фундаментальная реакция в химии.
Образование соли: Оставшиеся ионы — катионы кальция (Ca²⁺) и анионы хлора (Cl⁻) — объединяются, образуя соль хлорид кальция (CaCl₂). Хлорид кальция является хорошо растворимой солью, поэтому раствор становится прозрачным.
Термодинамика: Реакция нейтрализации является экзотермической, хотя и менее бурной, чем гашение извести.
Практическое значение: Хлорид кальция используется как осушитель, противогололедное средство, в пищевой промышленности. Эта реакция также лежит в основе титрования для определения концентрации кислот или оснований.
б) Cu → CuO → 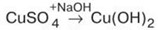
Эта цепочка демонстрирует химию меди, элемента с переменной валентностью, и ее соединений, включая окислительно-восстановительные реакции и реакции обмена.
1. Cu → CuO
Уравнение реакции: 2Cu (тв) + O₂ (г) = 2CuO (тв)
Тип реакции: Реакция соединения (синтеза), окислительно-восстановительная реакция (ОВР).
Электронные переходы и степени окисления: Медь (Cu⁰) окисляется, отдавая два электрона и переходя в степень окисления +2 (Cu²⁺). Кислород (O⁰) восстанавливается, принимая электроны и переходя в степень окисления -2 (O²⁻).
Активность меди: Медь является менее активным металлом по сравнению с кальцием. Она не реагирует с кислородом при комнатной температуре, что объясняет ее использование в электропроводке и сантехнике (не ржавеет на воздухе). Однако при нагревании энергия активации реакции преодолевается, и медь активно окисляется.
Наблюдения: Поверхность красной меди покрывается черным слоем оксида меди(II).
Практическое значение: Эта реакция является причиной потускнения медных изделий (патинация, хотя патина часто включает и другие соединения).
2. CuO → CuSO₄
Уравнение реакции: CuO (тв) + H₂SO₄ (водн) = CuSO₄ (водн) + H₂O (ж)
Полное ионное уравнение: CuO (тв) + 2H⁺(водн) + SO₄²⁻(водн) = Cu²⁺(водн) + SO₄²⁻(водн) + H₂O (ж)
Сокращенное ионное уравнение: CuO (тв) + 2H⁺(водн) = Cu²⁺(водн) + H₂O (ж)
Тип реакции: Реакция обмена, кислотно-основная реакция (взаимодействие основного оксида с кислотой).
Свойства оксида меди(II): CuO является основным оксидом (хотя и амфотерный в очень сильных щелочах, но здесь ведет себя как основной). Серная кислота (H₂SO₄) — сильная кислота. Основные оксиды реагируют с кислотами, образуя соль и воду. В этой реакции черный оксид меди(II) растворяется в серной кислоте, образуя прозрачный раствор сульфата меди(II) (CuSO₄). Раствор приобретает характерный голубой цвет, обусловленный гидратированными ионами Cu²⁺([Cu(H₂O)₆]²⁺).
Термодинамика: Реакция экзотермическая, и нагревание ускоряет растворение CuO.
Практическое значение: Это один из промышленных способов получения сульфата меди(II), который используется как фунгицид (бордосская жидкость), альгицид, в гальванотехнике.
3.
Уравнение реакции: CuSO₄ (водн) + 2NaOH (водн) = Na₂SO₄ (водн) + Cu(OH)₂↓ (тв)
Полное ионное уравнение: Cu²⁺(водн) + SO₄²⁻(водн) + 2Na⁺(водн) + 2OH⁻(водн) = 2Na⁺(водн) + SO₄²⁻(водн) + Cu(OH)₂ (тв)
Сокращенное ионное уравнение: Cu²⁺(водн) + 2OH⁻(водн) = Cu(OH)₂ (тв)
Тип реакции: Реакция обмена (двойного замещения), реакция осаждения.
Принцип осаждения: Эта реакция является классическим примером реакции осаждения, которая происходит, когда при смешивании двух растворов образуется нерастворимое вещество. Гидроксид меди(II) (Cu(OH)₂) очень малорастворим в воде (его произведение растворимости Ksp очень мало).
Наблюдения: При добавлении раствора щелочи (например, NaOH) к раствору сульфата меди(II) немедленно образуется характерный голубой студенистый осадок Cu(OH)₂. Это качественная реакция на ионы меди.
Практическое значение: Используется для качественного обнаружения ионов Cu²⁺, а также как промежуточный этап в производстве некоторых соединений меди.
4. Cu(OH)₂ → CuO
Уравнение реакции: Cu(OH)₂ (тв) = CuO (тв) + H₂O (г)
Тип реакции: Реакция разложения (термическое разложение).
Термическая неустойчивость: Гидроксиды многих металлов, особенно тех, которые образуют малорастворимые гидроксиды (как Cu(OH)₂), термически неустойчивы. При нагревании они разлагаются на соответствующий оксид и воду.
Наблюдения: Голубой осадок Cu(OH)₂ при нагревании постепенно чернеет, превращаясь в черный порошок CuO, и выделяются пары воды.
Температурный режим: Разложение начинается уже при относительно невысоких температурах (около 80-100°C).
Практическое значение: Этот метод используется для получения чистого оксида меди(II) из его гидроксида.
5. CuO → Cu
Уравнение реакции: CuO (тв) + H₂ (г) = Cu (тв) + H₂O (г)
Тип реакции: Окислительно-восстановительная реакция (ОВР), реакция замещения.
Роль восстановителя: Водород (H₂) является сильным восстановителем, особенно при повышенных температурах. Он способен отнимать кислород у оксидов менее активных металлов.
Электронные переходы и степени окисления: Медь в CuO находится в степени окисления +2 (Cu²⁺) и восстанавливается до металлической меди (Cu⁰), принимая два электрона. Водород в H₂ находится в степени окисления 0 (H⁰) и окисляется до +1 (H⁺) в молекуле воды, отдавая электроны.
Наблюдения: Черный порошок CuO при нагревании в токе водорода постепенно превращается в красно-коричневую металлическую медь. На холодных стенках пробирки конденсируются капельки воды.
Практическое значение: Эта реакция является классическим лабораторным способом получения чистой меди. Принципы восстановления оксидов металлов водородом (или другими восстановителями, такими как углерод) широко используются в металлургии.
в) фосфор → оксид фосфора(V) → фосфорная кислота → фосфат калия
Эта цепочка иллюстрирует химию неметалла фосфора, его кислотного оксида и соответствующих кислот.
1. фосфор → оксид фосфора(V)
Уравнение реакции: 4P (тв) + 5O₂ (г) = 2P₂O₅ (тв)
Тип реакции: Реакция соединения (синтеза), окислительно-восстановительная реакция (ОВР).
Аллотропия фосфора: Фосфор существует в нескольких аллотропных модификациях. Белый фосфор очень реакционноспособен и самовоспламеняется на воздухе при комнатной температуре. Красный фосфор менее реакционноспособен, но активно горит при нагревании.
Электронные переходы: Фосфор (P⁰) окисляется до степени окисления +5 (P⁵⁺), отдавая электроны. Кислород (O⁰) восстанавливается до -2 (O²⁻), принимая электроны.
Строение P₂O₅: Оксид фосфора(V) на самом деле существует в виде димера P₄O₁₀, представляющего собой молекулярное соединение с тетраэдрической структурой, где атомы фосфора связаны через кислородные мостики. Это белый, очень гигроскопичный порошок.
Термодинамика: Реакция горения фосфора сильно экзотермическая, сопровождается выделением большого количества света и тепла.
Практическое значение: P₂O₅ является мощным осушителем и используется для удаления воды из газов и жидкостей.
2. оксид фосфора(V) → фосфорная кислота
Уравнение реакции: P₂O₅ (тв) + 3H₂O (ж) = 2H₃PO₄ (водн)
Тип реакции: Реакция соединения (синтеза), гидратация кислотного оксида.
Свойства кислотного оксида: P₂O₅ является типичным кислотным оксидом (ангидридом фосфорной кислоты). Он очень активно взаимодействует с водой.
Механизм реакции: Молекулы P₄O₁₀ распадаются в воде, и атомы фосфора образуют связи с атомами кислорода и водорода из воды, формируя молекулы фосфорной кислоты H₃PO₄.
Термодинамика: Реакция экзотермическая, сопровождается выделением тепла.
Практическое значение: Это промышленный способ получения фосфорной кислоты, которая является одной из важнейших неорганических кислот. Она используется в производстве удобрений, моющих средств, пищевых добавок (например, в газированных напитках).
3. фосфорная кислота → фосфат калия
Уравнение реакции: H₃PO₄ (водн) + 3KOH (водн) = K₃PO₄ (водн) + 3H₂O (ж)
Полное ионное уравнение: H₃PO₄ (водн) + 3K⁺(водн) + 3OH⁻(водн) = 3K⁺(водн) + PO₄³⁻(водн) + 3H₂O (ж)
Сокращенное ионное уравнение: H₃PO₄ (водн) + 3OH⁻(водн) = PO₄³⁻(водн) + 3H₂O (ж)
Тип реакции: Реакция обмена (нейтрализации), кислотно-основная реакция.
Многоосновная кислота: Фосфорная кислота (H₃PO₄) является трехосновной кислотой, то есть она способна отдавать три протона (H⁺). Гидроксид калия (KOH) — сильное одноосновное основание.
Полная нейтрализация: Для полной нейтрализации H₃PO₄ требуется три моля KOH на один моль кислоты, чтобы образовалась средняя соль — фосфат калия (K₃PO₄).
Растворимость: Фосфат калия является хорошо растворимой солью.
Практическое значение: Фосфаты калия используются как калийные удобрения, так как они содержат два важных для растений элемента — калий и фосфор. Также применяются в пищевой промышленности.
г) кремний → оксид кремния(IV) → силикат натрия 
Эта цепочка демонстрирует химию кремния, его оксида, а также особенности кремниевых соединений, включая их термическую стабильность и образование гелей.
1. кремний → оксид кремния(IV)
Уравнение реакции: Si (тв) + O₂ (г) = SiO₂ (тв)
Тип реакции: Реакция соединения (синтеза), окислительно-восстановительная реакция (ОВР).
Активность кремния: Кремний является неметаллом, но он менее реакционноспособен, чем фосфор или углерод. При комнатной температуре он не реагирует с кислородом.
Электронные переходы: Кремний (Si⁰) окисляется до степени окисления +4 (Si⁴⁺), отдавая электроны. Кислород (O⁰) восстанавливается до -2 (O²⁻), принимая электроны.
Строение SiO₂: Оксид кремния(IV) (SiO₂) имеет уникальную гигантскую ковалентную структуру (как алмаз, но с кислородными мостиками). Каждый атом кремния связан с четырьмя атомами кислорода, а каждый атом кислорода — с двумя атомами кремния. Это объясняет его высокую твердость, тугоплавкость и химическую инертность.
Условия: Реакция требует сильного нагревания (сотни градусов Цельсия).
Практическое значение: SiO₂ является основным компонентом песка, кварца, стекла и керамики. Это один из самых распространенных оксидов на Земле.
2. оксид кремния(IV) → силикат натрия
Уравнение реакции: SiO₂ (тв) + Na₂O (тв) = Na₂SiO₃ (тв)
Тип реакции: Реакция соединения (синтеза), взаимодействие кислотного оксида с основным оксидом (реакция сплавления).
Особенности SiO₂: В отличие от большинства кислотных оксидов неметаллов, SiO₂ не реагирует с водой при обычных условиях из-за своей прочной кристаллической структуры. Однако при высоких температурах он проявляет свои кислотные свойства, взаимодействуя с основными оксидами или щелочами.
Механизм: При сплавлении (очень высокой температуре) происходит разрушение ковалентной сетки SiO₂ и образование ионного силиката натрия (Na₂SiO₃).
Практическое значение: Эта реакция является основой производства стекла, где SiO₂ сплавляется с оксидами щелочных и щелочноземельных металлов. Силикат натрия, растворенный в воде, известен как «жидкое стекло» и используется как клей, пропитка для тканей и древесины, компонент моющих средств.
3. силикат натрия
Уравнение реакции: Na₂SiO₃ (водн) + H₂SO₄ (водн) = Na₂SO₄ (водн) + H₂SiO₃↓ (тв)
Полное ионное уравнение: 2Na⁺(водн) + SiO₃²⁻(водн) + 2H⁺(водн) + SO₄²⁻(водн) = 2Na⁺(водн) + SO₄²⁻(водн) + H₂SiO₃ (тв)
Сокращенное ионное уравнение: SiO₃²⁻(водн) + 2H⁺(водн) = H₂SiO₃ (тв)
Тип реакции: Реакция обмена (двойного замещения), реакция осаждения.
Свойства кремниевой кислоты: Кремниевая кислота (H₂SiO₃) является очень слабой и нерастворимой кислотой. Она существует в виде студенистого осадка (геля).
Принцип осаждения: Когда к раствору силиката (соли слабой кислоты) добавляется сильная кислота, сильная кислота вытесняет слабую кислоту из ее соли, и поскольку кремниевая кислота нерастворима, она выпадает в осадок.
Наблюдения: При добавлении кислоты к раствору «жидкого стекла» немедленно образуется белый, студенистый, похожий на желе осадок.
Практическое значение: Эта реакция используется для получения кремниевой кислоты, которая после сушки превращается в силикагель — пористый материал, широко используемый как адсорбент и осушитель.
4. кремниевая кислота → оксид кремния(IV)
Уравнение реакции: H₂SiO₃ (тв) = SiO₂ (тв) + H₂O (г)
Тип реакции: Реакция разложения (термическое разложение).
Объяснение: Кремниевая кислота (H₂SiO₃) является очень слабой и термически неустойчивой кислотой. При нагревании она легко разлагается на оксид кремния(IV) (SiO₂) и воду. Это один из способов получения чистого диоксида кремния из силикатов.
Условия: Нагревание.
Наблюдения: Белый осадок кремниевой кислоты теряет воду, превращаясь в белый порошок SiO₂.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.





Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!