
Учебник «Химия» для 8-го класса, написанный Габриеляном и Остроумовым, представляет собой качественное учебное пособие, которое помогает школьникам погрузиться в мир химии и освоить ее основные понятия. Книга отличается доступным языком изложения, продуманной структурой и ярким оформлением, что делает процесс изучения увлекательным и понятным.
ГДЗ по Химии 8 Класс Параграф 31 Вопрос 14 Габриелян, Остроумов — Подробные Ответы
Предложите вариант графического отображения памятки о порядке заполнения электронных слоёв у атомов № 1—20 в таблице Д. И. Менделеева.
| Период | Элементы и их электронное строение |
|---|---|
| Первый период | 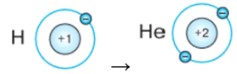 |
| Второй период | 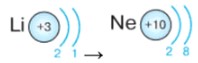 |
| Третий период | 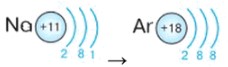 |
| Четвертый период | 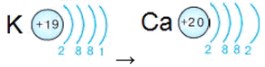 |
Для создания наглядной памятки о порядке заполнения электронных слоев у атомов с порядковыми номерами от 1 до 20 используется графическое представление, подобное тому, что обычно встречается в учебниках химии. Этот подход позволяет визуализировать структуру атома и распределение электронов по энергетическим уровням (оболочкам).
Вариант графического отображения памятки:
Памятка представлена в виде таблицы, где каждая строка соответствует периоду в периодической системе, а в ячейках изображены модели атомов (по модели Бора) с указанием количества электронов на каждом энергетическом уровне.
Структура таблицы:
Период: Первый период. Элементы: H, He.
Период: Второй период. Элементы: Li, Ne.
Период: Третий период. Элементы: Na, Ar.
Период: Четвертый период. Элементы: K, Ca.
Содержание каждой ячейки (пример для H, He, Li, Ne, Na, Ar, K, Ca):
Для каждого атома отображается:
1. Символ элемента (например, H, He, Li, Ne, Na, Ar, K, Ca).
2. Ядро атома: Представлено кругом с указанием заряда ядра (равного порядковому номеру элемента, например, +1 для H, +2 для He, +3 для Li и т.д.).
3. Электронные оболочки: Изображены в виде концентрических окружностей вокруг ядра. Количество окружностей соответствует номеру периода, в котором находится элемент.
4. Распределение электронов: На каждой окружности (оболочке) указывается количество электронов. Это может быть реализовано цифрами под моделью атома (например, 2, 8, 1 для Na) или точками/значками электронов на самих окружностях.
Создание такой памятки базируется на основных принципах строения атома и заполнения электронных оболочек.
1. Порядковый номер элемента (Z): В нейтральном атоме порядковый номер равен числу протонов в ядре и числу электронов. Это фундаментальное свойство, определяющее элемент. Например, у водорода (H) Z=1, что означает 1 протон и 1 электрон. У кальция (Ca) Z=20, что означает 20 протонов и 20 электронов.
2. Периоды в периодической системе: Номер периода, в котором находится элемент, указывает на количество энергетических уровней (электронных оболочек), занятых электронами в атоме этого элемента.
- Первый период: Атомы имеют 1 электронную оболочку.
- Второй период: Атомы имеют 2 электронные оболочки.
- Третий период: Атомы имеют 3 электронные оболочки.
- Четвертый период: Атомы имеют 4 электронные оболочки.
3. Правила заполнения электронных оболочек: Электроны заполняют энергетические уровни, начиная с ближайшего к ядру (самого низкого по энергии). Каждый уровень имеет максимальную вместимость:
- Первый уровень (K-оболочка): Максимум 2 электрона.
- Второй уровень (L-оболочка): Максимум 8 электронов.
- Третий уровень (M-оболочка): Максимум 18 электронов. Однако для элементов главных подгрупп до кальция включительно, он часто заполняется до 8 электронов, прежде чем начинается заполнение следующего уровня. Это связано с энергетическим порядком заполнения подоболочек (4s заполняется раньше 3d).
- Четвертый уровень (N-оболочка): Начинает заполняться после того, как третий уровень достигнет 8 электронов (для элементов 4-го периода главных подгрупп).
Применение этих правил для формирования памятки (для атомов № 1-20):
Первый период (1 оболочка):
- Водород (H, Z=1): Имеет 1 электрон. Он располагается на первой оболочке. Электронная конфигурация: (1).
- Гелий (He, Z=2): Имеет 2 электрона. Оба располагаются на первой оболочке. Электронная конфигурация: (2). Первая оболочка заполнена, что делает гелий химически инертным.
Второй период (2 оболочки):
- Литий (Li, Z=3): Имеет 3 электрона. Первая оболочка заполняется до 2 электронов. Оставшийся 1 электрон занимает вторую оболочку. Электронная конфигурация: (2, 1).
- … (Далее следуют Be (2,2), B (2,3), C (2,4), N (2,5), O (2,6), F (2,7)).
- Неон (Ne, Z=10): Имеет 10 электронов. Первая оболочка (2), вторая оболочка (8). Электронная конфигурация: (2, 8). Вторая оболочка заполнена, неон инертен.
Третий период (3 оболочки):
- Натрий (Na, Z=11): Имеет 11 электронов. Первая оболочка (2), вторая оболочка (8). Оставшийся 1 электрон занимает третью оболочку. Электронная конфигурация: (2, 8, 1).
- … (Далее следуют Mg (2,8,2) … Cl (2,8,7)).
- Аргон (Ar, Z=18): Имеет 18 электронов. Первая оболочка (2), вторая оболочка (8), третья оболочка (8). Электронная конфигурация: (2, 8, 8). Третья оболочка (для элементов главных подгрупп) считается заполненной, аргон инертен.
Четвертый период (4 оболочки):
- Калий (K, Z=19): Имеет 19 электронов. Первая оболочка (2), вторая оболочка (8), третья оболочка (8). Оставшийся 1 электрон занимает четвертую оболочку (хотя третья еще не заполнена до 18, 4s-подоболочка имеет более низкую энергию, чем 3d-подоболочка). Электронная конфигурация: (2, 8, 8, 1).
- Кальций (Ca, Z=20): Имеет 20 электронов. Первая оболочка (2), вторая оболочка (8), третья оболочка (8). Оставшиеся 2 электрона занимают четвертую оболочку. Электронная конфигурация: (2, 8, 8, 2).
Выводы для памятки:
- Такая графическая памятка наглядно демонстрирует:
- Связь между номером периода и количеством электронных оболочек.
- Последовательное заполнение электронных оболочек.
- «Правило октета» (или дублета для первого периода) для благородных газов, которые имеют полностью заполненные внешние электронные оболочки, что объясняет их химическую инертность.
- Количество валентных электронов (электронов на внешней оболочке), которое определяет химические свойства элемента.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.





Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!